von Dr. Alexej Dronov
Statistik und Sichtungsnachweis dieser Seite findet sich am Artikelende
| [1.] Ad/Fragment 028 01 - Diskussion Zuletzt bearbeitet: 2014-07-09 19:51:37 Hindemith | Ad, Fragment, Gesichtet, Kazak 2002, SMWFragment, Schutzlevel sysop, Verschleierung |
|
|
| Untersuchte Arbeit: Seite: 28, Zeilen: 1 ff. (kpl.) |
Quelle: Kazak 2002 Seite(n): 24, 25, Zeilen: 24:13 ff - 25: 1 ff. |
|---|---|
| Während ihrer Begegnung mit Antigenen produzieren naive CD4+-T-Lymphozyten (entspricht Th0-Zellen) initial geringe Mengen IL-2, IL-4 und IFN-γ (NAKAMURA et al. 1997). Die Entscheidung, in welchen Th-Subtypen sie sich entwickeln, scheint in hohem Maße von Zytokinen abzuhängen, denen sie bei der primären Aktivierung auf der Ebene der TCR-Bindung ausgesetzt sind (ABBAS et al. 1996; SEDER R. A. & PAUL W. E. 1994).
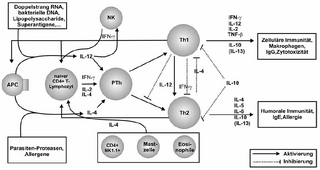
IL-12, rasch nach dem Kontakt von aktivierten Makrophagen mit mikrobiellen Produkten, Lipopolysacchariden, Viruskomponenten, intrazellulären Bakterien (Listeria monocytogenes und Mykobakterien) und Protozoen (TRINCHIERI 1997) und dem Kontakt mit antigenpräsentierenden Zellen (=APC, z.b. dendritischen Zellen) (MACATONIA et al. 1995) produziert, ist das bedeutendste Th1-induzierende Zytokin, während IL-4 (SWAIN et al. 1990) das wichtigste Th2-induzierende Zytokin zu sein scheint (Abb.1) Abbildung 1: Differenzierung von CD4+-T-Helfer-Subtypen zu Th1- bzw. Th2-Zellen (APC=antigenpräsentierende Zelle) (Modifiziert nach MURAILLE & LEO 1998; PICHLER 1997) Mikroorganismen, wie z.B. Listerien und Mykobakterien, die Makrophagen und NK-Zellen aktivieren, stimulieren die Produktion von IL-12 und IFNγ (HSIEH et al. 1993; TRINCHIERI 1995; GAZZINELLI et al. 1993). IL-12 aktiviert zudem auch bei NK-Zellen die IFN-γ-Produktion (GAZZINELLI et al. 1993). IFN-γ wiederum bewirkt eine erhöhte Ausschüttung von IL-12 bei Makrophagen. Kürzlich aktivierte, unbeteiligte CD4+-Vorläufer- Lymphozyten [(pTh) bilden Rezeptoren für IL-12 und bekommen eine erhöhte Ansprechbarkeit auf IL-12 (WENNER et al. 1996), da IFN-γ eine Aufregulation der β2-Untereinheit des IL-12-Rezeptors bewirkt (ROGGE et al. 1997).] |
Während ihrer Begegnung mit Antigenen produzieren naive CD4+-T-Lymphozyten (entspricht Th0-Zellen) initial geringe Mengen IL-2, IL-4 und IFN-g (107). Die Entscheidung, in welchen Th-Subtypen sie sich entwickeln, scheint in hohem Maße von Zytokinen abzuhängen, denen sie bei der primären Aktivierung auf der Ebene der TCR-Bindung ausgesetzt sind (99, 106). IL-12, rasch nach dem Kontakt von aktivierten Makrophagen mit mikrobiellen Produkten, Lipopolysacchariden, Viruskomponenten, intrazellulären Bakterien (Listeria monocytogenes und Mykobakterien) und Protozoen (108) und dem Kontakt mit antigen-präsentierende Zellen (=APC, z.B. dendritischen Zellen) (109) produziert, ist das bedeutendste Th1-induzierende Zytokin, während IL-4 (110) das wichtigste Th2-induzierende Zytokin zu sein scheint (Abbildung 3).
[Seite 25] Abbildung 3: Differenzierung von CD4+-T-Helfer-Subtypen zu Th1- bzw. Th2-Zellen (APC = antigenpräsentierende Zelle) (111, 112) Mikroorganismen, wie z.B. Listerien und Mykobakterien, die Makrophagen und NK-Zellen aktivieren, stimulieren die Produktion von IL-12 und IFNg (87, 101, 113). IL-12 aktiviert zudem auch bei NK-Zellen die IFN-g-Produktion (113). IFN-g wiederum bewirkt eine erhöhte Ausschüttung von IL-12 bei Makrophagen. Kürzlich aktivierte, unbeteiligte CD4+-Vorläufer-Lymphozyten (pTh) bilden Rezeptoren für IL-12 und bekommen eine erhöhte Ansprechbarkeit auf IL-12 (114), da IFN-g eine Upregulation der b2-Untereinheit des IL-12-Rezeptors bewirkt (115). 87. Hsieh, C. S., Macatonia, S. E., Tripp, C. S., Wolf, S. F., O'Garra, A., and Murphy, K. M.: Development of TH1 CD4+ T cells through IL-12 produced by Listeriainduced macrophages [see comments]. Science 260 (5107) (1993), S. 547-549 99. Abbas, A. K., Murphy, K. M., and Sher, A.: Functional diversity of helper T lymphocytes. Nature 383 (6603) (1996), S. 787-793 107. Nakamura, T., Kamogawa, Y., Bottomly, K., and Flavell, R. A.: Polarization of IL-4- and IFN-gamma-producing CD4+ T cells following activation of naive CD4+ T cells. J.Immunol. 158 (3) (1997), S. 1085-1094 108. Trinchieri, G.: Cytokines acting on or secreted by macrophages during intracellular infection (IL-10, IL-12, IFN-gamma). Curr.Opin.Immunol. 9 (1) (1997), S. 17-23 109. Macatonia, S. E., Hosken, N. A., Litton, M., Vieira, P., Hsieh, C. S., Culpepper, J. A., Wysocka, M., Trinchieri, G., Murphy, K. M., and O'Garra, A.: Dendritic cells produce IL-12 and direct the development of Th1 cells from naive CD4+ T cells. J.Immunol. 154 (10) (1995), S. 5071-5079 110. Swain, S. L., Weinberg, A. D., English, M., and Huston, G.: IL-4 directs the development of Th2-like helper effectors. J.Immunol. 145 (11) (1990), S. 3796-3806 111. Muraille, E. and Leo, O.: Revisiting the Th1/Th2 paradigm. Scand.J.Immunol. 47 (1) (1998), S. 1-9 112. Pichler, W. J.: [Regulation of the immune response: the TH1/TH2 concept]. Schweiz.Med.Wochenschr. 127 (9) (1997), S. 341-348 113. Gazzinelli, R. T., Hieny, S., Wynn, T. A., Wolf, S., and Sher, A.: Interleukin 12 is required for the T-lymphocyte-independent induction of interferon gamma by an intracellular parasite and induces resistance in T-cell-deficient hosts. Proc.Natl.Acad.Sci.U.S.A. 90 (13) (1993), S. 6115-6119 |
Kein Hinweis auf die Quelle. Referenzen werden mitübernommen. |
|
Letzte Bearbeitung dieser Seite: durch Benutzer:Hindemith, Zeitstempel: 20140709195157