32 gesichtete, geschützte Fragmente: Plagiat
| [1.] Xsc/Fragment 045 01 - Diskussion Bearbeitet: 17. November 2014, 22:17 Singulus Erstellt: 14. November 2014, 00:16 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 45, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 49, 50, Zeilen: 49: 17 ss.; 50: 1 ss. |
|---|---|
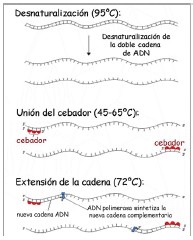
| [Otros métodos, raramente empleados en la técnica de la PCR,] serían la adición de sales o agentes químicos capaces de realizar la desnaturalización.
2. Unión del cebador. A continuación se producirá la hibridación del cebador, es decir, el cebador se unirá a su secuencia complementaria en el ADN molde. Para esto es necesario que la temperatura descienda (generalmente, a 55 ºC, aunque se puede variar según sea el caso entre 45ºC y 65ºC). Estos cebadores actuarán como límites de la región de la molécula que va a ser amplificada. 3. Extensión de la cadena. Por último actúa la ADN polimerasa, tomando el ADN molde para sintetizar la cadena complementaria y partiendo del cebador como soporte inicial necesario para la síntesis de nuevo ADN. Se aumenta la temperatura hasta 72 ºC (para la ADN Polimerasa), temperatura a la cual la Taq pol presenta su máximo de actividad, aumentando geométricamente la cantidad de fragmentos de ADN amplificados en la reacción. Figura 8. Fases de la PCR-semicuantitativa Una vez completados todos los ciclos, se finaliza con dos pasos, uno de extensión de la cadena a la temperatura óptima de esta ADN polimerasa, [normalmente 72ºC, para finalizar enfriando la muestra a 4ºC para su mantenimiento.] |
Otros métodos, raramente empleados en la técnica de la PCR, serían la adición de sales o agentes químicos capaces de realizar la desnaturalización.
2. Unión del cebador. A continuación se producirá la hibridación del cebador, es decir, el cebador se unirá a su secuencia complementaria en el ADN molde. Para esto es necesario que la temperatura descienda (generalmente, a 55 ºC, aunque se puede variar según sea el caso entre 45ºC y 65ºC). Estos cebadores actuarán como límites de la región de la molécula que va a ser amplificada. 3. Extensión de la cadena. Por último actúa la ADN polimerasa, tomando el ADN molde para sintetizar la cadena complementaria y partiendo del cebador como soporte inicial necesario para la síntesis de nuevo ADN. Se [página 50] aumenta la temperatura hasta 72 ºC (para la ADN Polimerasa), temperatura a la cual la Taq pol presenta su máximo de actividad, aumentando geométricamente la cantidad de fragmentos de ADN amplificados en la reacción. Figura 8. Fases de la PCR-semicuantitativa Una vez completados todos los ciclos, se finaliza con dos pasos, uno de extensión de la cadena a la temperatura óptima de esta ADN polimerasa, normalmente 72ºC, para finalizar enfriando la muestra a 4ºC para su mantenimiento. |
No se menciona la fuente. |
|
| [2.] Xsc/Fragment 053 01 - Diskussion Bearbeitet: 17. November 2014, 21:53 Hindemith Erstellt: 14. November 2014, 00:35 (Hindemith) | Fragment, Gesichtet, Rajaha 2012, SMWFragment, Schutzlevel sysop, Verschleierung, Xsc |
|
|
| Untersuchte Arbeit: Seite: 53, Zeilen: 1-2 |
Quelle: Rajaha 2012 Seite(n): 1 (internet), Zeilen: - |
|---|---|

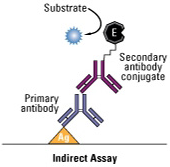
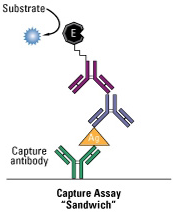
Figura 9. Representación esquemática de los diferentes tipos de ELISA (directo, indirecto y sándwich) |
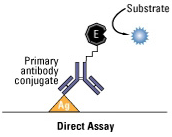
[...] [...] |
No se menciona ninguna fuente. |
|
| [3.] Xsc/Fragment 047 01 - Diskussion Bearbeitet: 17. November 2014, 21:53 Hindemith Erstellt: 14. November 2014, 00:21 (Hindemith) | Cervello 2009, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Xsc |
|
|
| Untersuchte Arbeit: Seite: 47, Zeilen: 1-8 |
Quelle: Cervello 2009 Seite(n): 51, Zeilen: 6 ss. |
|---|---|
| Para cada reacción de PCR se estandarizó 94ºC 5 minutos para desnaturalización de ADN; 38 ciclos de 94ºC 45 segundos, 61ºC 45 segundos, 60ºC 45 segundos y una extensión final a 72ºC 5 minutos, para posteriormente ir a 4ºC.
Los fragmentos de ADNc amplificados fueron separados mediante electroforesis durante 45 minutos a 90 V en gel de agarosa al 1.5% (p/v), con 0,5 μg/mL de bromuro de etidio y finalmente fueron observados bajo luz ultravioleta. |
Para cada reacción de PCR se estandarizó 94ºC 5 minutos para desnaturalización de ADN; 40 ciclos de 94ºC 45 segundos, 61ºC 45 segundos, 72ºC 45 segundos y una extensión final a 72ºC 5 minutos, para posteriormente ir a 4ºC.
Los fragmentos de ADNc amplificados fueron separados mediante electroforesis durante 1 hora a 90 V en gel de agarosa al 2% (p/v), con 0,5 μg/mL de bromuro de etidio y finalmente fueron observados bajo luz ultravioleta. |
No se menciona la fuente. |
|
| [4.] Xsc/Fragment 046 01 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 14. November 2014, 00:18 (Hindemith) | Cervello 2009, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Xsc |
|
|
| Untersuchte Arbeit: Seite: 46, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 50, 51, Zeilen: 50: 5 ss.; 51: 1 ss. |
|---|---|
| [Una vez completados todos los ciclos, se finaliza con dos pasos, uno de extensión de la cadena a la temperatura óptima de esta ADN polimerasa,] normalmente 72ºC, para finalizar enfriando la muestra a 4ºC para su mantenimiento.
La técnica de PCR semi-cuantitativa se usa para determinar la presencia o ausencia de las secuencias buscadas. La PCR semi-cuantitativa fue conformada con 4μL del producto del paso de la retrotranscripción. A ese volumen de ADNc le fue añadido la mezcla de reacción que contenía 2,5 μL de tampón de reacción 10X (SYBR-Green, Bio-Rad Laboratories, Hercules, CA), 1,25 μL de MgCl2 50mM (SYBR-Green), 15,5 μL de agua DEPC, 0,5 μL de mezcla de dNTPs (SYBR-Green), 0,5 μL de cebadores 5´ y 3´ a 20mM, 0,25 μL de Taq pol hasta llegar a un volumen final de 25 μL. Las reacciones de PCR fueron llevadas a cabo en un termociclador Bio-Rad (Bio-Rad, Hercules, CA). Como control negativo de la técnica en cada PCR se sustituyó el ADNc por agua bidestilada comprobando en estos casos que no existía amplificado alguno. Las secuencias de los cebadores utilizados se diseñó mediante el programa informático Primer BLAST y los tamaños y temperaturas de annealiing del fragmento que amplifica se muestran en la siguiente tabla. |
Una vez completados todos los ciclos, se finaliza con dos pasos, uno de extensión de la cadena a la temperatura óptima de esta ADN polimerasa, normalmente 72ºC, para finalizar enfriando la muestra a 4ºC para su mantenimiento.
La técnica de PCR semi-cuantitativa se usa para determinar la presencia o ausencia de las secuencias buscadas. La PCR semi-cuantitativa fue conformada con 4μL del producto del paso de la retrotranscripción. A ese volumen de ADNc le fue añadido la mezcla de reacción que contenía 2,5 μL de tampón de reacción 10X (Bioline, Londres, Inglaterra), 1,25 μL de MgCl2 50mM (Bioline), 15,5 μL de agua DEPC, 0,5 μL de mezcla de dNTPs (Sigma-Aldrich, Madrid, España), 0,5 μL de cebadores 5´ y 3´ a 20mM, 0,25 μL de Taq pol (Bioline) hasta llegar a un volumen final de 25 μL. Las reacciones de PCR fueron llevadas a cabo en un termociclador UnoII (Biometra, Gottingen, Alemania). Como control negativo de la técnica en cada PCR se sustituyó el [página 51] ADNc por agua bidestilada comprobando en estos casos que no existía amplificado alguno. Las secuencias de los cebadores utilizados se diseñó mediante programas informáticos y los tamaños del fragmento que amplifica se muestran en la siguiente tabla. |
No se menciona la fuente. |
|
| [5.] Xsc/Fragment 044 08 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 14. November 2014, 00:10 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 44, Zeilen: 8-29 |
Quelle: Cervello 2009 Seite(n): 48, 49, Zeilen: 48: 26 ss. ; 49: 1 ss. |
|---|---|
| Esta técnica sirve para amplificar un fragmento de ADN diana. Esta técnica se fundamenta en la propiedad natural de las ADN polimerasas para replicar hebras de ADN, para lo cual emplea ciclos a altas y bajas temperaturas alternadas para separar las hebras de ADN recién formadas entre sí tras cada fase de replicación y, a continuación, dejar que vuelvan a unirse a polimerasas para que vuelvan a duplicarlas.
Para la realización de esta técnica es necesario el diseño de cebadores para la PCR, también denominados primers, que son oligonucleótidos sintéticos que hibridan con la región que se desea amplificar y propician el inicio de la reacción de elongación por la Taq pol (ADN polimerasa). Los cebadores suelen ser secuencias cortas, de entre seis y cuarenta nucleótidos, normalmente de 18 a 22, que son reconocidos por la polimerasa permitiendo iniciar la reacción. Deben estar situados enfrentados y a no mucha distancia entre ellos (no más de 4 kb). Delimitan la zona de ADN a amplificar. La PCR semi-cuantitativa proceso tiene tres fases (figura 8): 1. Desnaturalización. En primer lugar, se desnaturaliza el ADN (se separan las dos hebras de las cuales está constituido). Este paso puede realizarse de diferentes modos, siendo el calentamiento (94-95ºC) de la muestra la forma más habitual. La temperatura a la cual se decide realizar la desnaturalización depende, entre otras cosas, de la proporción de G+C (guanina-citosina) que tenga la hebra, como también del largo de la misma. Otros métodos, raramente empleados en la técnica de la PCR, [serían la adición de sales o agentes químicos capaces de realizar la desnaturalización.] |
Esta técnica sirve para amplificar un fragmento de ADN diana. Esta técnica se fundamenta en la propiedad natural de las ADN polimerasas para replicar hebras de ADN, para lo cual emplea ciclos a altas y bajas temperaturas alternadas para separar las hebras de ADN recién formadas entre sí tras cada
[página 49] fase de replicación y, a continuación, dejar que vuelvan a unirse a polimerasas para que vuelvan a duplicarlas. Para la realización de esta técnica es necesario el diseño de cebadores para la PCR, también denominados primers, que son oligonucleótidos sintéticos que hibridan con la región que se desea amplificar y propician el inicio de la reacción de elongación por la Taq pol (ADN polimerasa). Los cebadores suelen ser secuencias cortas, de entre seis y cuarenta nucleótidos, normalmente de 18 a 22, que son reconocidos por la polimerasa permitiendo iniciar la reacción. Deben estar situados enfrentados y a no mucha distancia entre ellos (no más de 4 kb). Delimitan la zona de ADN a amplificar. La PCR semi-cuantitativa proceso tiene tres fases (figura 8): 1. Desnaturalización. En primer lugar, se desnaturaliza el ADN (se separan las dos hebras de las cuales está constituido). Este paso puede realizarse de diferentes modos, siendo el calentamiento (94-95ºC) de la muestra la forma más habitual. La temperatura a la cual se decide realizar la desnaturalización depende, entre otras cosas, de la proporción de G+C (guanina-citosina) que tenga la hebra, como también del largo de la misma. Otros métodos, raramente empleados en la técnica de la PCR, serían la adición de sales o agentes químicos capaces de realizar la desnaturalización. |
No se menciona la fuente. |
|
| [6.] Xsc/Fragment 041 01 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 14. November 2014, 00:06 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 41, Zeilen: 1-8 |
Quelle: Cervello 2009 Seite(n): 60, Zeilen: 6 ss. |
|---|---|
| • Análisis de alto numero de partículas en corto tiempo (5.000 eventos /seg).
• Alta sensibilidad y objetividad. • Medidas separadas de cada célula (no sólo el promedio). • Medidas cuantitativas: discriminación de las células según la cantidad de marcador. • Múltiples parámetros: define subpoblaciones complejas. • Miles de células por segundo. |
• Análisis de alto numero de partículas en corto tiempo (5.000 eventos /seg).
• Alta sensibilidad y objetividad. • Medidas separadas de cada célula (no sólo el promedio). • Medidas cuantitativas: discriminación de las células según la cantidad de marcador. • Múltiples parámetros: define subpoblaciones complejas. • Miles de células por segundo. |
No se menciona la fuente. |
|
| [7.] Xsc/Fragment 040 01 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 14. November 2014, 00:00 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 40, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 59, 60, Zeilen: 59: 9 ss.; 60: 1 ss. |
|---|---|
| - Marcadores del potencial de membrana: son las cianinas y la rodamina 123. También marcan mitocondrias debido a la alta diferencia de potencial entre su membrana.
- Marcadores de membrana y lípidos, marcadores que diferencian compartimentos con distinto pH: poco usados en citometría de flujo. Realización de citometría de flujo. Se hace en 3 etapas independientes: • Fase pre-citometría: preparación de los reactivos, preparación de las células, diseño del protocolo y coloración de las células con los reactivos fluorescentes. • Fase de citometría de flujo: involucra el procesamiento de las células marcadas y la recolección de los datos para cada una de las medidas (parámetros) realizados en cada célula individual. • Fase de análisis: análisis de los datos recolectados. La mezcla de células teñidas con diferentes fluorocromos es forzada a pasar a través de una aguja creando una delgada fila de líquido que contiene las células. A medida que cada célula pasa en frente del láser, desvía el rayo incidente y las moléculas teñidas unidas a la célula van a ser excitadas y emiten luz fluorescente. Tubos fotomultiplicadores detectan tanto la luz desviada y las emisiones fluorescentes, la información es digitalizada y procesada por el ordenador. Los resultados son presentados a manera de histogramas o "dot-plots". Ventajas de la citometría de flujo. Las ventajas de esta técnica son las siguientes: • Análisis y cuantificación de un número estadísticamente significativo de células (desde 1.000 a más de 100.000 células). • Múltiples marcajes de una sola célula. |
- Marcadores del potencial de membrana: son las cianinas y la rodamina 123. También marcan mitocondrias debido a la alta diferencia de potencial entre su membrana.
- Marcadores de membrana y lípidos, marcadores que diferencian compartimentos con distinto pH: poco usados en citometría de flujo. Realización de citometría de flujo. Se hace en 3 etapas independientes: • Fase pre-citometría: preparación de los reactivos, preparación de las células, diseño del protocolo y coloración de las células con los reactivos fluorescentes. • Fase de citometría de flujo: involucra el procesamiento de las células marcadas y la recolección de los datos para cada una de las medidas (parámetros) realizados en cada célula individual. • Fase de análisis: análisis de los datos recolectados. La mezcla de células teñidas con diferentes fluorocromos es forzada a pasar a través de una aguja creando una delgada fila de líquido que contiene las células. A medida que cada célula pasa en frente del láser, desvía el rayo incidente y las moléculas teñidas unidas a la célula van a ser excitadas y emiten luz fluorescente. Tubos fotomultiplicadores detectan tanto la luz desviada y las emisiones fluorescentes, la información es digitalizada y procesada por el ordenador. Los resultados son presentados a manera de histogramas o "dot-plots". [página 60] Ventajas de la citometría de flujo. Las ventajas de esta técnica son las siguientes: • Análisis y cuantificación de un número estadísticamente significativo de células (desde 1.000 a más de 100.000 células). • Múltiples marcajes de una sola célula. |
No se menciona la fuente. |
|
| [8.] Xsc/Fragment 039 01 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 13. November 2014, 23:57 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 39, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 58, 59, Zeilen: 58: 11 ss.; 59: 1 ss. |
|---|---|
| Reactivos fluorescentes.
Disponemos en la actualidad de diferentes marcadores de fluorescencia dependiendo de su unión a la célula. • Marcadores fluorescentes de unión covalente: son fluorocromos que reaccionan y se usan para marcar proteínas, lípidos, o bien otras moléculas biológicas. Deben ser suficientemente selectivos y reactivos. Se emplean cromóforos con grupos isotiocianato, clorotrirzinil, y ésteres de succinimida, por su capacidad de unión. El fluorocromo más empleado es la fluoresceína. Otros que se han descrito y empleado son: rodamina, Texas red, cianinas (láseres diodos), etc., pero el más famoso es la ficoeritrina (ficobiliproteína) por su gran absorción, rendimiento y fotoestabilidad; además se puede excitar a 488 nm pero emite más allá del espectro de la fluoresceína permitiendo el doble análisis con un solo láser. Actualmente se ha generalizado el estudio multiparamétrico de antígenos celulares con el empleo simultáneo de 3 y 4 anticuerpos conjugados cada uno con fluorocromos con diferente longitud de emisión (FITC; R-PE, PerCP, AFC, tándems de fluorocromos, etc). • Marcadores fluorescentes de unión no covalente: son fluorocromos que debido e su especial composición molecular se unen a determinados componentes celulares. Entre ellos: - Marcadores del contenido en ADN y ARN: Según el tipo son más o menos específicos para el ADN, ARN, o determinadas bases. Se emplean el Hoechst 33342 (Unión a A-T, vital), DAPI (A-T), DIPI (A-T), cromomicina A3 (Unión a G-C), olivomicina (G-C), mitramicina (G-C). El naranja de acridina se une al ADN y ARN pero tiene la particularidad de emitir en diferente longitud según al tipo de ácido nucleico al que está unido. De uso común es el Yoduro de Propidio (PI, unión intercalante) que se excita con un láser de 488 nm. |
Reactivos fluorescentes.
Disponemos en la actualidad de diferentes marcadores de fluorescencia dependiendo de su unión a la célula. • Marcadores fluorescentes de unión covalente: son fluorocromos que reaccionan y se usan para marcar proteínas, lípidos, o bien otras moléculas biológicas. Deben ser suficientemente selectivos y reactivos. Se emplean cromóforos con grupos isotiocianato, clorotrirzinil, y ésteres de succinimida, por su capacidad de unión. El fluorocromo más empleado es la fluoresceína. Otros que se han descrito y empleado son: rodamina, Texas red, cianinas (láseres diodos), etc., pero el más famoso es la ficoeritrina (ficobiliproteína) por su gran absorción, rendimiento y fotoestabilidad; además se puede excitar a 488 nm pero emite más allá del espectro de la fluoresceína permitiendo el doble análisis con un solo láser. Actualmente se ha generalizado el estudio multiparamétrico de antígenos celulares con el empleo simultáneo de 3 y 4 anticuerpos conjugados cada uno con fluorocromos con diferente longitud de emisión (FITC; R-PE, PerCP, AFC, tándems de fluorocromos, etc). • Marcadores fluorescentes de unión no covalente: son fluorocromos que debido e su especial composición molecular se unen a determinados componentes celulares. Entre ellos: [página 59] - Marcadores del contenido en ADN y ARN: Según el tipo son más o menos específicos para el ADN, ARN, o determinadas bases. Se emplean el Hoechst 33342 (Unión a A-T, vital), DAPI (A-T), DIPI (A-T), cromomicina A3 (Unión a G-C), olivomicina (G-C), mitramicina (G-C). El naranja de acridina se une al ADN y ARN pero tiene la particularidad de emitir en diferente longitud según al tipo de ácido nucleico al que está unido. De uso común es el Yoduro de Propidio (PI, unión intercalante) que se excita con un láser de 488 nm. |
No se menciona la fuente. |
|
| [9.] Xsc/Fragment 038 01 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 13. November 2014, 23:54 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 38, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 57, 58, Zeilen: 57: 11 ss.; 58: 1 ss. |
|---|---|
| [La luz dispersada a 90 grados del eje del haz lumínico (side scatter, SS a 90] grados) está relacionada con la estructura interna y la complejidad citoplasmática.
La excitación de los fluorocromos ocurre en el punto de interacción de la célula y el haz lumínico, dando como resultado la emisión de una luz de longitud de onda superior a la incidente. Esta luz es recogida a 90 grados, siendo dirigidas las longitudes de onda seleccionadas mediante espejos (dicroicos) y filtros de banda que fotomultiplican la señal. Si se dispone de múltiples fluorocromos, excitables con la fuente de luz única, pueden unirse a las células permitiendo, de este modo, medidas fluorescentes simultáneas de varios parámetros de una sola célula. Las señales eléctricas analógicas son convertidas en señales digitales y son procesadas por un ordenador, con el fin de generar histogramas correlacionados con los parámetros deseados y efectuar el análisis de los mismos. Fluorescencia. El citómetro de flujo necesita un sistema combinado de: • Fluidos, para introducir y restringir las células para análisis. Óptica, una fuente de excitación y un sistema colección para generar y recoger las señales luminosas. El sistema de excitación consiste en un láser, lentes y prismas para dirigir el rayo. El sistema de colección consiste en espejos ópticos y filtros para encaminar determinadas longitudes de onda hacia detectores ópticos determinados. • Electrónica, para convertir las señales ópticas en señales electrónicas proporcionales y digitalizarlas para análisis computacional. Un fluorocromo es una molécula química que absorbe la luz a una determinada longitud de onda (energía) de excitación y emite a una longitud superior (menor energía). Interacciona con la luz de excitación procedente del láser. Se utiliza unido a anticuerpos específicos para antígenos de la célula. La cantidad de fluorescencia que emite una célula es proporcional a la cantidad de sitios de unión. |
La luz dispersada a 90 grados del eje del haz lumínico (side scatter, SS a 90 grados) está relacionada con la estructura interna y la complejidad citoplasmática.
La excitación de los fluorocromos ocurre en el punto de interacción de la célula y el haz lumínico, dando como resultado la emisión de una luz de longitud de onda superior a la incidente. Esta luz es recogida a 90 grados, siendo dirigidas las longitudes de onda seleccionadas mediante espejos (dicroicos) y filtros de banda que fotomultiplican la señal. Si se dispone de múltiples fluorocromos, excitables con la fuente de luz única, pueden unirse a las células permitiendo, de este modo, medidas fluorescentes simultáneas de varios parámetros de una sola célula. Las señales eléctricas analógicas son convertidas en señales digitales y son procesadas por un ordenador, con el fin de generar histogramas correlacionados con los parámetros deseados y efectuar el análisis de los mismos. Fluorescencia. El citómetro de flujo necesita un sistema combinado de: • Fluidos, para introducir y restringir las células para análisis. • Óptica, una fuente de excitación y un sistema colección para generar y recoger las señales luminosas. El sistema de excitación consiste en un láser, lentes y prismas para dirigir el rayo. El sistema de colección [página 58] consiste en espejos ópticos y filtros para encaminar determinadas longitudes de onda hacia detectores ópticos determinados. • Electrónica, para convertir las señales ópticas en señales electrónicas proporcionales y digitalizarlas para análisis computacional. Un fluorocromo es una molécula química que absorbe la luz a una determinada longitud de onda (energía) de excitación y emite a una longitud superior (menor energía). Interacciona con la luz de excitación procedente del láser. Se utiliza unido a anticuerpos específicos para antígenos de la célula. La cantidad de fluorescencia que emite una célula es proporcional a la cantidad de sitios de unión. |
No se menciona la fuente. |
|
| [10.] Xsc/Fragment 037 04 - Diskussion Bearbeitet: 17. November 2014, 21:52 Hindemith Erstellt: 13. November 2014, 23:49 (Hindemith) | Cervello 2009, Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Xsc |
|
|
| Untersuchte Arbeit: Seite: 37, Zeilen: 4-28 |
Quelle: Cervello 2009 Seite(n): 56, 57, Zeilen: 56: 17 ss. ; 57: 1 ss. |
|---|---|
| Citometría de flujo
La citometría de flujo (CMF) es una técnica de análisis celular multiparamétrico cuyo fundamento se basa en hacer pasar una suspensión de partículas (generalmente células) alineadas por delante de un haz de láser focalizado. Es una tecnología que permite la medida simultánea de múltiples características físicas de una sola célula. Estas medidas son realizadas mientras las células pasan en fila, a una velocidad de 500 a 4000 células por segundo, a través del aparato de medida en flujo laminar. Es esencial disponer de una suspensión de células o partículas individuales, de modo que la dificultad para obtenerla es un factor limitante para el empleo de la técnica. Y esto va en aumento si se desea trabajar con células vivas. Las células o partículas son marcadas por colorantes fluorescentes que son capaces de excitarse con una fuente luminosa de alta energía. La citometría de flujo se utilizó para conocer la viabilidad celular, aislar las células que expresaban insulina, conocer la pureza de la muestra y fenotipar con diferentes las célulsa madre con diferentes marcadores de superficie (apartados de resultados). La suspensión celular convenientemente procesada y teñida, se inyecta en la cámara de flujo del citómetro que está hidrodinámicamente enfocada para que las células pasen individualmente, una detrás de otra, a través de un punto en que estas interaccionan físicamente con un haz de luz monocromática, la luz al incidir sobre las células produce una dispersión en todas las direcciones. La luz dispersada hacia adelante (llamada forward scatter, FS a 0 grados) está relacionada con el tamaño celular. La luz dispersada a 90 grados del eje del haz lumínico (side scatter, SS a 90 [grados) está relacionada con la estructura interna y la complejidad citoplasmática.] |
3.2.2 Citometría de flujo.
La citometría de flujo (CMF) es una técnica de análisis celular multiparamétrico cuyo fundamento se basa en hacer pasar una suspensión de partículas (generalmente células) alineadas por delante de un haz de láser focalizado. Es una tecnología que permite la medida simultánea de múltiples características físicas de una sola célula. Estas medidas son realizadas mientras las células pasan en fila, a una velocidad de 500 a 4000 células por segundo, a través del aparato de medida en flujo laminar. Es esencial disponer de una suspensión de células o partículas individuales, de modo que la dificultad para obtenerla es un factor limitante para el empleo de la técnica. Y esto va en aumento si se desea trabajar con células vivas. Las células o partículas son marcadas por colorantes fluorescentes que son capaces de excitarse con una fuente luminosa de alta energía. La citometría de flujo se utilizó para conocer la viabilidad celular (apartado 3.2.3), aislar las células de la side population (SP, ver apartado [página 57] 3.2.5), conocer la pureza de la muestra (apartado 3.2.3), y fenotipar con diferentes marcadores tanto las suspensiones celulares de epitelio y estroma como las células SP aisladas desde estas fracciones celulares (apartados 3.5.1 y 3.5.2). La suspensión celular convenientemente procesada y teñida, se inyecta en la cámara de flujo del citómetro que está hidrodinámicamente enfocada para que las células pasen individualmente, una detrás de otra, a través de un punto en que estas interaccionan físicamente con un haz de luz monocromática, la luz al incidir sobre las células produce una dispersión en todas las direcciones. La luz dispersada hacia adelante (llamada forward scatter, FS a 0 grados) está relacionada con el tamaño celular. La luz dispersada a 90 grados del eje del haz lumínico (side scatter, SS a 90 grados) está relacionada con la estructura interna y la complejidad citoplasmática. |
No se menciona la fuente. |
|
| [11.] Xsc/Fragment 024 01 - Diskussion Bearbeitet: 17. November 2014, 21:44 Hindemith Erstellt: 13. November 2014, 11:40 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 24, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 24, 25, Zeilen: 24: 1ss. ; 25: 1 ss. |
|---|---|
| [En otros estudios clínicos las evidencias de la presencia de células madre somáticas en el endometrio vienen asociadas a la propensión de este tejido a sufrir calcificación/osificación (frecuentemente tras el embarazo) lo que se asocia frecuentemente con dolor e inflamación crónica, estas condiciones] especiales en otros tejidos regenerativos son conocidas por ser originadas por células madre mesenquimales (Van Os y cols., 2004). En el endometrio encontramos células del músculo liso, hueso y cartílago. Las células madre mesenquimales tienen la capacidad de diferenciarse en células del músculo liso, hueso, grasa, y cartílago en condiciones in vivo e in vitro (Gronthos y cols., 2003). El conjunto de todas estas observaciones sugiere la hipótesis de que bajo determinadas circunstancias las células residentes en el endometrio o células mesenquimales multipotentes derivadas de la médula ósea puedan llevar a cabo una inapropiada diferenciación.
Monoclonalidad de las glándulas endometriales Las glándulas endometriales parecen tener un origen monoclonal, es decir se han formado desde una única célula progenitora o célula madre. En más de la mitad de los cortes histológicos estudiados pertenecientes a muestras endometriales normales en fase proliferativa muy pocas glándulas presentaban la ausencia de la proteína PTEN debido a una mutación y/o deleción en el gen PTEN (Mutter, 2000). Un factor clave en el desarrollo de la hiperplasia y del cáncer endometrial es la inactivación del gen supresor de tumores PTEN (Phosphatase and tensin homolog) por medio de deleción o inactivación. Los estrógenos aumentan la producción glandular de la proteína PTEN, que se expresa constantemente durante la fase proliferativa pero que está ausente durante la fase secretora. En ausencia de PTEN, las células endometriales se vuelven más sensibles a la estimulación por estrógenos imprescindible para el desarrollo de hiperplasias y cáncer posterior. De hecho se ha comprobado que los clones de glándulas mutantes en PTEN (mujeres con glándulas nulas en este gen) en las muestras estudiadas persistían en la capa basal durante los ciclos menstruales y regeneraban sus respectivas glándulas con ausencia del gen PTEN en la capa funcional en los siguientes ciclos. Las glándulas que no presentaban PTEN aumentaban concretamente en hiperplasias endometriales, un desorden de la proliferación epitelial. En otro estudio diferente, la monoclonalidad de las glándulas fue también probada por la técnica de PCR (Tanaka y cols., 2003a). |
En otros estudios clínicos las evidencias de la presencia de células madre somáticas en el endometrio vienen asociadas a la propensión de este tejido a sufrir calcificación/osificación (frecuentemente tras el embarazo) lo que se asocia frecuentemente con dolor e inflamación crónica, estas condiciones especiales en otros tejidos regenerativos son conocidas por ser originadas por células madre mesenquimales (Van Os y cols., 2004). En el endometrio encontramos células del músculo liso, hueso y cartílago. Las células madre mesenquimales tienen la capacidad de diferenciarse en células del músculo liso, hueso, grasa, y cartílago en condiciones in vivo e in vitro (Gronthos y cols., 2003). El conjunto de todas estas observaciones sugiere la hipótesis de que bajo determinadas circunstancias las células residentes en el endometrio o células mesenquimales multipotentes derivadas de la médula ósea puedan llevar a cabo una inapropiada diferenciación.
Monoclonalidad de las glándulas endometriales Las glándulas endometriales parecen tener un origen monoclonal, es decir se han formado desde una única célula progenitora o célula madre. En más de la mitad de los cortes histológicos estudiados pertenecientes a muestras endometriales normales en fase proliferativa muy pocas glándulas presentaban la ausencia de la proteína PTEN debido a una mutación y/o deleción en el gen PTEN (Mutter, 2000). Un factor clave en el desarrollo de la hiperplasia y del cáncer endometrial es la inactivación del gen supresor de tumores PTEN (Phosphatase and tensin homolog) por medio de deleción o inactivación. Los estrógenos aumentan la producción glandular de la proteína PTEN, que se expresa constantemente durante la fase proliferativa pero que está ausente durante la fase secretora. En ausencia de PTEN, las células endometriales se vuelven más sensibles a la estimulación por estrógenos imprescindible para el desarrollo de hiperplasias y cáncer posterior. De hecho se ha comprobado que los clones de glándulas mutantes en PTEN (mujeres con glándulas nulas en este gen) en las muestras estudiadas persistían en la capa basal durante los ciclos menstruales y regeneraban sus respectivas glándulas con ausencia del gen PTEN en la capa funcional en los siguientes [página 25] ciclos. Las glándulas que no presentaban PTEN aumentaban concretamente en hiperplasias endometriales, un desorden de la proliferación epitelial. En otro estudio diferente, la monoclonalidad de las glándulas fue también probada por la técnica de PCR (Tanaka y cols., 2003a). |
La fuente no se menciona |
|
| [12.] Xsc/Fragment 025 01 - Diskussion Bearbeitet: 17. November 2014, 21:44 Hindemith Erstellt: 13. November 2014, 11:35 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 25, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 25, Zeilen: 4 ss. |
|---|---|
| [Estudios demostraron] que glándulas adyacentes compartían clonalidad indicando que determinadas regiones bien delimitadas del endometrio derivaban de un mismo precursor celular, sugiriendo que determinadas glándulas comparten el origen desde una misma célula madre. Todo esto da lugar a cuestiones sobre la localización precisa de las candidatas a células madre somáticas epiteliales. | Estudios demostraron que glándulas adyacentes compartían clonalidad indicando que determinadas regiones bien delimitadas del endometrio derivaban de un mismo precursor celular, sugiriendo que determinadas glándulas comparten el origen desde una misma célula madre. Todo esto da lugar a cuestiones sobre la localización precisa de las candidatas a células madre somáticas epiteliales. |
La fuente no se menciona. |
|
| [13.] Xsc/Fragment 023 01 - Diskussion Bearbeitet: 17. November 2014, 21:44 Hindemith Erstellt: 13. November 2014, 11:27 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 23, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 23, 24, Zeilen: 23: 4 ss.; 24: 1 ss. |
|---|---|
| [El alcance de las metilaciones de las glándulas endometriales incrementa con la edad hasta la menopausia, después de la cual se mantienen] prácticamente constantes, indicando que el número de errores epigéneticos es un reflejo de la actividad mitótica que pueden tener las células madre somáticas dentro de ese tejido. Los modelos matemáticos de los datos son más consistentes con el concepto de que una glándula individual contiene un nicho de células madre somáticas. Un nicho con número desconocido de células madre pero con larga vida más que una célula madre inmortal que se divide siempre de forma asimétrica. Parecería que las divisiones celulares simétricas y asimétricas ocurren de manera estocástica para mantener un número constante de células madre en el nicho de la glándula endometrial. Más evidencias indicaron que un reservorio de células madre somáticas permanece en el endometrio atrófico, ya que no hay reducción de la diversidad de glándulas endometriales después de la menopausia. Estos errores de replicación aleatorios que se acumulan a lo largo del tiempo proporcionan un registro en la historia de la replicación de las células madre endometriales, él cual podría ser usado para la investigación del posible papel de las células madre o progenitoras en desordenes proliferativos del endometrio.
Evidencias desde observaciones clínicas. Otras evidencias indirectas sobre la existencia de células madre somáticas en el endometrio humano derivan del estudio con primates y de la práctica clínica, dónde se ha demostrado que el endometrio se regenera por completo y se puede llevar a cabo un embarazo tras la eliminación quirúrgica de casi todo el tejido endometrial (Hartman, 1944; Wood y Rogers, 1993). En otras situaciones clínicas, fracciones pequeñas de tejido endometrial son capaces de regenerar el endometrio completo tras ablación electro-quirúrgica por menorragias, y además el embarazo en estas pacientes ha sido probado (Tressera y cols., 1999; Abbot y Garry, 2002). En otros estudios clínicos las evidencias de la presencia de células madre somáticas en el endometrio vienen asociadas a la propensión de este tejido a sufrir calcificación/osificación (frecuentemente tras el embarazo) lo que se asocia frecuentemente con dolor e inflamación crónica, estas condiciones [especiales en otros tejidos regenerativos son conocidas por ser originadas por células madre mesenquimales (Van Os y cols., 2004).] |
El alcance de las metilaciones de las glándulas endometriales incrementa con la edad hasta la menopausia, después de la cual se mantienen prácticamente constantes, indicando que el número de errores epigéneticos es un reflejo de la actividad mitótica que pueden tener las células madre somáticas dentro de ese tejido. Los modelos matemáticos de los datos son más consistentes con el concepto de que una glándula individual contiene un nicho de células madre somáticas. Un nicho con número desconocido de células madre pero con larga vida más que una célula madre inmortal que se divide siempre de forma asimétrica. Parecería que las divisiones celulares simétricas y asimétricas ocurren de manera estocástica para mantener un número constante de células madre en el nicho de la glándula endometrial. Más evidencias indicaron que un reservorio de células madre somáticas permanece en el endometrio atrófico, ya que no hay reducción de la diversidad de glándulas endometriales después de la menopausia. Estos errores de replicación aleatorios que se acumulan a lo largo del tiempo proporcionan un registro en la historia de la replicación de las células madre endometriales, él cual podría ser usado para la investigación del posible papel de las células madre o progenitoras en desordenes proliferativos del endometrio.
Evidencias desde observaciones clínicas. Otras evidencias indirectas sobre la existencia de células madre somáticas en el endometrio humano derivan del estudio con primates y de la práctica clínica, dónde se ha demostrado que el endometrio se regenera por completo y se puede llevar a cabo un embarazo tras la eliminación quirúrgica de casi todo el tejido endometrial (Hartman, 1944; Wood y Rogers, 1993). En otras situaciones clínicas, fracciones pequeñas de tejido endometrial son capaces de regenerar el endometrio completo tras ablación electro-quirúrgica por menorragias, y además el embarazo en estas pacientes ha sido probado (Tressera y cols., 1999; Abbot y Garry, 2002). [página 24] En otros estudios clínicos las evidencias de la presencia de células madre somáticas en el endometrio vienen asociadas a la propensión de este tejido a sufrir calcificación/osificación (frecuentemente tras el embarazo) lo que se asocia frecuentemente con dolor e inflamación crónica, estas condiciones especiales en otros tejidos regenerativos son conocidas por ser originadas por células madre mesenquimales (Van Os y cols., 2004). |
La fuente no se menciona. |
|
| [14.] Xsc/Fragment 022 01 - Diskussion Bearbeitet: 17. November 2014, 21:44 Hindemith Erstellt: 13. November 2014, 00:15 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 22, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 22, 23, Zeilen: 22: 4 ss.; 23: 1 ss. |
|---|---|
| Estudios cinéticos sobre proliferación celular endometrial muestran diferencias en esta proliferación entre las distintas zonas, que predicen un reemplazamiento ordenado de la células estromales y epiteliales en la capa funcional desde posibles células madre residentes en la capa basal cerca del limite miometrio-endometrio, y cuya progenie serían las células TA que proliferarían rápidamente y que podrían ser observadas en la capa funcional (Ferenczy y cols., 1979; Padykula y cols., 1989).
Recientemente, y basándose en las evidencias anteriormente citadas se usaron histonas fosforiladas (H3) como marcadores de proliferación celular en macacos sometidos a ciclos hormonales artificiales, se apreciaron diferencias entre el índice de proliferación de las glándulas endometriales situadas en la capa basal y las situadas en la capa funcional en las distintas etapas del ciclo menstrual (Brenner y cols., 2003). Patrones de metilación en glándulas endometriales. La cinética de las células epiteliales endometriales también ha sido estudiada a través del análisis de errores epigenéticos codificados en los patrones de metilación de glándulas individuales del endometrio humano (Kim y cols., 2005). En un tejido de remodelación y recambio cíclico como es el caso del endometrio, un remplazamiento tan continuo indica variantes epigéneticas heredables en las células madre que se producen en el ADN de la célula sin afectar a los genes, tales variantes (entre ellas las metilaciones) o mutaciones son perdidas durante el desprendimiento de esa capa. Por lo tanto, el número de divisiones de las células madre puede deducirse del número de errores somáticos acumulados dentro de las glándulas individuales. Los lugares de metilación del gen CSX (cardiac-specific homeobox), un gen silenciado del endometrio humano, fueron examinados para asegurarse de que cualquier cambio en los patrones de metilación era debido a consecuencias no funcionales y por lo tanto podía asociarse a procesos aleatorios relacionados con la edad. El alcance de las metilaciones de las glándulas endometriales incrementa con la edad hasta la menopausia, después de la cual se mantienen [prácticamente constantes, indicando que el número de errores epigéneticos es un reflejo de la actividad mitótica que pueden tener las células madre somáticas dentro de ese tejido.] |
Estudios cinéticos sobre proliferación celular endometrial muestran diferencias en esta proliferación entre las distintas zonas, que predicen un reemplazamiento ordenado de la células estromales y epiteliales en la capa funcional desde posibles células madre residentes en la capa basal cerca del limite miometrio-endometrio, y cuya progenie serían las células TA que proliferarían rápidamente y que podrían ser observadas en la capa funcional (Ferenczy y cols., 1979; Padykula y cols., 1989).
Recientemente, y basándose en las evidencias anteriormente citadas se usaron histonas fosforiladas (H3) como marcadores de proliferación celular en macacos sometidos a ciclos hormonales artificiales, se apreciaron diferencias entre el índice de proliferación de las glándulas endometriales situadas en la capa basal y las situadas en la capa funcional en las distintas etapas del ciclo menstrual (Brenner y cols., 2003). Patrones de metilación en glándulas endometriales. La cinética de las células epiteliales endometriales también ha sido estudiada a través del análisis de errores epigenéticos codificados en los patrones de metilación de glándulas individuales del endometrio humano (Kim y cols., 2005). En un tejido de remodelación y recambio cíclico como es el caso del endometrio, un remplazamiento tan continuo indica variantes epigéneticas heredables en las células madre que se producen en el ADN de la célula sin afectar a los genes, tales variantes (entre ellas las metilaciones) o mutaciones son perdidas durante el desprendimiento de esa capa. Por lo tanto, el número de divisiones de las células madre puede deducirse del número de errores somáticos acumulados dentro de las glándulas individuales. Los lugares de metilación del gen CSX (cardiac-specific homeobox), un gen silenciado del [página 23] endometrio humano, fueron examinados para asegurarse de que cualquier cambio en los patrones de metilación era debido a consecuencias no funcionales y por lo tanto podía asociarse a procesos aleatorios relacionados con la edad. El alcance de las metilaciones de las glándulas endometriales incrementa con la edad hasta la menopausia, después de la cual se mantienen prácticamente constantes, indicando que el número de errores epigéneticos es un reflejo de la actividad mitótica que pueden tener las células madre somáticas dentro de ese tejido. |
La fuente no se menciona. |
|
| [15.] Xsc/Fragment 021 01 - Diskussion Bearbeitet: 17. November 2014, 21:44 Hindemith Erstellt: 13. November 2014, 00:13 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 21, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 21, 22, Zeilen: 21: 3ss. ; 22: 1 ss. |
|---|---|
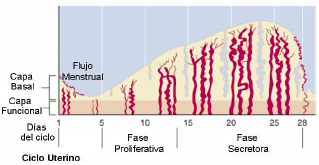
| [La progesterona limita el efecto proliferativo de los estrógenos en el endometrio y favorece la diferenciación de los distintos componentes celulares, que incluye] la secreción glandular de glucógeno, glicoproteínas y la decidualización del estroma. Además los vasos sanguíneos endometriales continúan su crecimiento, adquiriendo una apariencia tortuosa. Todos estos cambios están enfocados a la preparación del endometrio para la implantación del embrión.
En ausencia de fecundación, el cuerpo lúteo regresa y, por tanto, los niveles de hormonas ováricas (estrógenos y progesterona) caen bruscamente, produciéndose la involución y descamación del endometrio, generando el flujo menstrual (figura 4). Figura 4. Cambios ocurridos en el endometrio humano durante las distintas fases del ciclo menstrual. 2.3 Evidencias indirectas sobre la existencia de células madre somáticas en el endometrio humano. El concepto de que la regeneración endometrial debe estar mediada por células madre somáticas localizadas en la capa basal del tejido endometrial fue ya propuesto por primera vez hace 35 años (Prianishnikov, 1978). Estudios clásicos ya sugerían la posible existencia de células madre somáticas en el endometrio humano de manera indirecta. |
La progesterona limita el efecto proliferativo de los estrógenos en el endometrio y favorece la diferenciación de los distintos componentes celulares, que incluye la secreción glandular de glucógeno, glicoproteínas y la decidualización del estroma. Además los vasos sanguíneos endometriales continúan su crecimiento, adquiriendo una apariencia tortuosa. Todos estos cambios están enfocados a la preparación del endometrio para la implantación del embrión.
En ausencia de fecundación, el cuerpo lúteo regresa y, por tanto, los niveles de hormonas ováricas (estrógenos y progesterona) caen bruscamente, produciéndose la involución y descamación del endometrio, generando el flujo menstrual (figura 4). Figura 4. Cambios ocurridos en el endometrio humano durante las distintas fases del ciclo menstrual. 2.3 Evidencias indirectas sobre la existencia de células madre somáticas en el endometrio humano. El concepto de que la regeneración endometrial debe estar mediada por células madre somáticas localizadas en la capa basal del tejido endometrial fue [página 22] ya propuesto por primera vez hace 35 años (Prianishnikov, 1978). Estudios clásicos ya sugerían la posible existencia de células madre somáticas en el endometrio humano de manera indirecta. |
La fuente no se menciona. |
|
| [16.] Xsc/Fragment 020 01 - Diskussion Bearbeitet: 17. November 2014, 21:44 Hindemith Erstellt: 13. November 2014, 00:10 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 20, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 20, 21, Zeilen: 20: 3 ss.; 21: 1 ss. |
|---|---|
| 2.2 El ciclo menstrual.
Durante el ciclo menstrual, el endometrio sufre una serie de cambios en respuesta a fluctuaciones en los niveles de las hormonas esteroídeas procedentes del ovario. Estas hormonas ejercen su acción a través de mediadores locales producidos en las células del endometrio que a su vez actúan de manera paracrina sobre las células vecinas o sobre las propias células de manera autocrina (Giudice, 1994). Estos mediadores se pueden clasificar de manera general en factores de crecimiento, citoquinas y moléculas de adhesión. Teleológicamente, el objetivo del ciclo menstrual es preparar el endometrio para conseguir un embarazo con éxito. En él se pueden distinguir dos fases: la fase proliferativa y la fase secretora, separadas ambas por la ovulación. Fase proliferativa: también llamada folicular, ya que es durante esta fase donde se desarrolla el folículo que contiene el ovocito. Se extiende desde el final de la menstruación hasta la ovulación, y en ella existe una secreción elevada de estrógenos. En esta fase todos los componentes del endometrio sufren una intensa proliferación; se hacen visibles muchas mitosis y aumenta el grosor endometrial desde 0,5 mm hasta unos 7 mm (McLennan y Rydell, 1965). Se produce una inducción de los receptores de progesterona, que permitirán a las células responder a esta hormona durante la segunda mitad del ciclo. Varios factores de crecimiento y citoquinas como el factor de crecimiento epidérmico, factor de crecimiento similar a la insulina, factor de crecimiento de fibroblastos y el factor de crecimiento de células vasculares endoteliales entre otros, favorecen esta rápida proliferación. Fase secretora: comprendida desde el momento de la ovulación hasta la menstruación. También es conocida como fase lútea, puesto que se desarrolla el cuerpo lúteo en el ovario. La concentración de progesterona aumenta debido a la secreción del cuerpo lúteo, y los estrógenos permanecen altos. La progesterona limita el efecto proliferativo de los estrógenos en el endometrio y favorece la diferenciación de los distintos componentes celulares, que incluye [la secreción glandular de glucógeno, glicoproteínas y la decidualización del estroma.] |
2.2 El ciclo menstrual.
Durante el ciclo menstrual, el endometrio sufre una serie de cambios en respuesta a fluctuaciones en los niveles de las hormonas esteroídeas procedentes del ovario. Estas hormonas ejercen su acción a través de mediadores locales producidos en las células del endometrio que a su vez actúan de manera paracrina sobre las células vecinas o sobre las propias células de manera autocrina (Giudice, 1994). Estos mediadores se pueden clasificar de manera general en factores de crecimiento, citoquinas y moléculas de adhesión. Teleológicamente, el objetivo del ciclo menstrual es preparar el endometrio para conseguir un embarazo con éxito. En él se pueden distinguir dos fases: la fase proliferativa y la fase secretora, separadas ambas por la ovulación. Fase proliferativa: también llamada folicular, ya que es durante esta fase donde se desarrolla el folículo que contiene el ovocito. Se extiende desde el final de la menstruación hasta la ovulación, y en ella existe una secreción elevada de estrógenos. En esta fase todos los componentes del endometrio sufren una intensa proliferación; se hacen visibles muchas mitosis y aumenta el grosor endometrial desde 0,5 mm hasta unos 7 mm (McLennan y Rydell, 1965). Se produce una inducción de los receptores de progesterona, que permitirán a las células responder a esta hormona durante la segunda mitad del ciclo. Varios factores de crecimiento y citoquinas como el factor de crecimiento epidérmico, factor de crecimiento similar a la insulina, factor de crecimiento de fibroblastos y el factor de crecimiento de células vasculares endoteliales entre otros, favorecen esta rápida proliferación. Fase secretora: comprendida desde el momento de la ovulación hasta la menstruación. También es conocida como fase lútea, puesto que se [página 21] desarrolla el cuerpo lúteo en el ovario. La concentración de progesterona aumenta debido a la secreción del cuerpo lúteo, y los estrógenos permanecen altos. La progesterona limita el efecto proliferativo de los estrógenos en el endometrio y favorece la diferenciación de los distintos componentes celulares, que incluye la secreción glandular de glucógeno, glicoproteínas y la decidualización del estroma. |
La fuente no se menciona. |
|
| [17.] Xsc/Fragment 019 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 13. November 2014, 00:08 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 19, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 19, 20, Zeilen: 19: 1 ss.; 20: 1 ss. |
|---|---|
| [De manera global, el endometrio está compuesto por distintos tipos celulares, que incluyen] epitelio luminal y glandular, estroma, endotelio y de forma transitoria, células del sistema inmune.
- Epitelio: está constituido por una capa de células secretoras, ciliadas y cilíndricas simples. Este epitelio es continuo y contiene aberturas glandulares que se extienden a través del estroma subyacente hasta el borde miometrial. El epitelio endometrial se conecta en posición distal con el epitelio secretor del endocervix y, en posición proximal, con el epitelio tubárico. De esta monocapa depende la implantación embrionaria, controlando el impacto del embrión sobre el estroma y los vasos endometriales y actuando como primer contacto entre el blastocisto y su lecho endometrial. Se descama durante la menstruación, salvo la parte basal, pudiendo regenerarse de nuevo en el siguiente ciclo menstrual y, así volver a actuar de lecho endometrial. - Estroma: las células predominantes en el estroma son los fibroblastos, pero también se pueden identificar macrófagos, linfocitos y otros tipos de células residentes y migratorias. Parte de este estroma también se desprende durante la menstruación y del mismo modo es regenerado en el siguiente ciclo proporcionando de nuevo las condiciones adecuadas para la implantación embrionaria. - Endotelio y músculo liso vascular: estas células también están expuestas a los estímulos cíclicos que sufre el endometrio. Una respuesta apropiada de este sistema vascular es necesaria para dar lugar a un endometrio receptivo que soporte el desarrollo embrionario. - Células del sistema inmune: son células relevantes para la función reproductora, puesto que durante la implantación embrionaria existe una regulación de la respuesta inmune local. La población de células leucocitarias encontrada en un endometrio normal suele representar un 10-15% del estroma, incrementándose hasta un 20-25% en la fase secretora tardía y premenstrual (Bulmer y Johnson, 1985). La mayor parte de la población la componen las células NK (Natural Killer cells) y los macrófagos. |
De manera global, el endometrio está compuesto por distintos tipos celulares, que incluyen epitelio luminal y glandular, estroma, endotelio y de forma transitoria, células del sistema inmune.
- Epitelio: está constituido por una capa de células secretoras, ciliadas y cilíndricas simples. Este epitelio es continuo y contiene aberturas glandulares que se extienden a través del estroma subyacente hasta el borde miometrial. El epitelio endometrial se conecta en posición distal con el epitelio secretor del endocervix y, en posición proximal, con el epitelio tubárico. De esta monocapa depende la implantación embrionaria, controlando el impacto del embrión sobre el estroma y los vasos endometriales y actuando como primer contacto entre el blastocisto y su lecho endometrial. Se descama durante la menstruación, salvo la parte basal, pudiendo regenerarse de nuevo en el siguiente ciclo menstrual y, así volver a actuar de lecho endometrial. - Estroma: las células predominantes en el estroma son los fibroblastos, pero también se pueden identificar macrófagos, linfocitos y otros tipos de células residentes y migratorias. Parte de este estroma también se desprende durante la menstruación y del mismo modo es regenerado en el siguiente ciclo proporcionando de nuevo las condiciones adecuadas para la implantación embrionaria. - Endotelio y músculo liso vascular: estas células también están expuestas a los estímulos cíclicos que sufre el endometrio. Una respuesta apropiada de este sistema vascular es necesaria para dar lugar a un endometrio receptivo que soporte el desarrollo embrionario. - Células del sistema inmune: son células relevantes para la función reproductora, puesto que durante la implantación embrionaria existe una regulación de la respuesta inmune local. La población de células leucocitarias encontrada en un endometrio normal suele representar un 10-15% del estroma, incrementándose hasta un 20-25% en la fase secretora tardía y premenstrual [página 20] (Bulmer y Johnson, 1985). La mayor parte de la población la componen las células NK (Natural Killer cells) y los macrófagos. |
La fuente no se menciona. |
|
| [18.] Xsc/Fragment 018 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:25 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 18, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 17, 18, 19, Zeilen: 17: 28; 18: 1 ss.; 19: 1 ss. |
|---|---|
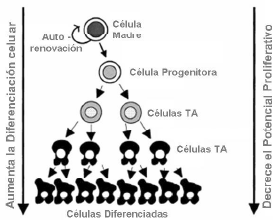
| [La función de las células madre somáticas está finamente regulada para asegurar el equilibrio adecuado entre el re-emplazamiento celular y la provisión de un] número suficiente de células maduras diferenciadas para el mantenimiento de la función de tejidos y órganos, sin dar lugar a la formación de tumores. El balance entre la auto-renovación y la diferenciación es necesario encontrándose regulado por las células madre del nicho.
Es indiscutible que las células madre no sólo residen y tienen función en tejidos con excepcional capacidad regenerativa como la médula ósea, el intestino y la epidermis, con una constante producción de células diferenciadas para su adecuado mantenimiento; sino también se ha demostrado su existencia en tejidos de bajo remplazamiento celular como el tejido neural, el páncreas, la próstata o el hígado. En estos tejidos, la función de las células madre somáticas es mantener la homeostasis celular a través de la reorganización del tejido debido a pérdida de células por apoptosis (Clarke y Smith, 2005). Tras un daño o desgaste, normalmente las células madre somáticas quiescentes entran nuevamente en el ciclo celular produciendo células denominadas células TA, las cuáles sufren ciclos de proliferación y expansión rápidos que permiten reparar la pérdida de tejido con reposición de células funcionales y totalmente diferenciadas. En algunos casos, como el hígado y el páncreas, células totalmente diferenciadas tienen la capacidad de revertir y posteriormente proliferar hacia un fenotipo celular que pueda tener el mismo efecto de renovación en su tejido de origen (Dor y Melton, 2004). 2. CELULAS MADRE SOMÁTICAS EN EL ENDOMETRIO HUMANO 2.1 El endometrio humano. El endometrio humano es un tejido muy dinámico que sufre cambios cíclicos específicos en respuesta a las hormonas ováricas circulantes. Desde el punto de vista histológico, el endometrio se divide en dos capas: la basal y la funcional. La funcional responde a la progesterona y el estradiol descamándose durante la menstruación. La basal no responde a las hormonas esteroídeas y no sufre descamación, regenerando el endometrio a partir de ella. De manera global, el endometrio está compuesto por distintos tipos celulares, que incluyen [epitelio luminal y glandular, estroma, endotelio y de forma transitoria, células del sistema inmune.] |
La función
[página 18] de las células madre somáticas está finamente regulada para asegurar el equilibrio adecuado entre el re-emplazamiento celular y la provisión de un número suficiente de células maduras diferenciadas para el mantenimiento de la función de tejidos y órganos, sin dar lugar a la formación de tumores. El balance entre la auto-renovación y la diferenciación es necesario encontrándose regulado por las células madre del nicho. Es indiscutible que las células madre no sólo residen y tienen función en tejidos con excepcional capacidad regenerativa como la médula ósea, el intestino y la epidermis, con una constante producción de células diferenciadas para su adecuado mantenimiento; sino también se ha demostrado su existencia en tejidos de bajo remplazamiento celular como el tejido neural, el páncreas, la próstata o el hígado. En estos tejidos, la función de las células madre somáticas es mantener la homeostasis celular a través de la reorganización del tejido debido a pérdida de células por apoptosis (Clarke y Smith, 2005). Tras un daño o desgaste, normalmente las células madre somáticas quiescentes entran nuevamente en el ciclo celular produciendo células denominadas células TA, las cuáles sufren ciclos de proliferación y expansión rápidos que permiten reparar la pérdida de tejido con reposición de células funcionales y totalmente diferenciadas. En algunos casos, como el hígado y el páncreas, células totalmente diferenciadas tienen la capacidad de revertir y posteriormente proliferar hacia un fenotipo celular que pueda tener el mismo efecto de renovación en su tejido de origen (Dor y Melton, 2004). 2. CELULAS MADRE SOMÁTICAS EN EL ENDOMETRIO HUMANO 2.1 El endometrio humano. El endometrio humano es un tejido muy dinámico que sufre cambios cíclicos específicos en respuesta a las hormonas ováricas circulantes. Desde el punto de vista histológico, el endometrio se divide en dos capas: la basal y la funcional. La funcional responde a la progesterona y el estradiol descamándose durante la menstruación. La basal no responde a las hormonas esteroídeas y [página 19] no sufre descamación, regenerando el endometrio a partir de ella. De manera global, el endometrio está compuesto por distintos tipos celulares, que incluyen epitelio luminal y glandular, estroma, endotelio y de forma transitoria, células del sistema inmune. |
La fuente no se menciona. |
|
| [19.] Xsc/Fragment 017 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:22 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 17, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 17, 18, Zeilen: 17: 1 ss.; 18: 1 ss. |
|---|---|
| [Se ha propuesto que esta conversión celular que implica de-diferenciación y re-diferenciación de las células pueda] suceder gracias a la reprogramación nuclear tanto a nivel genético como epigenético.
Diferentes experimentos demostraron inicialmente que células procedentes de la médula ósea pueden incorporarse en el tejido dañado a través del torrente sanguíneo y dar lugar a células del músculo esquelético, neuronas y glía, hepatocitos, células endoteliales, células del miocardio, células epiteliales del intestino, piel y pulmón; mientras que por otro lado también se ha demostrado que células neuronales producen células de la sangre y células musculares esqueléticas (Blau y cols., 2001). Sin embargo, este concepto de transdiferenciación ha sido ampliamente discutido y rechazado en muchos estudios por considerarse que se trata de un fenómeno de fusión celular (Álvarez-Dolado y cols., 2003). Se ha demostrado la fusión de células transplantadas con las células del huésped receptor (Liu y Rao, 2003). Se trata de un fenómeno infrecuente y puede ocurrir entre células y tejidos donde la poliploidía es un fenómeno biológico normal, como en los osteoclastos, miotúbulos, hepatocitos y placenta. No obstante, la fusión celular puede ser mal interpretada como transdiferenciación (Goodell, 2003; Cossu, 2004). Finalmente la transdiferenciación como mecanismo de plasticidad debe de seguir siendo analizada a través de las herramientas y pruebas experimentales realizadas con rigor científico incluyendo un adecuado diseño experimental y la exclusión de la posibilidad de fusión celular en estos ensayos. Papel en la homeostasis, reparación y regeneración. Las células madre procedentes de órganos y tejidos adultos juegan un papel clave en la homeostasis celular ya que promueven por un lado el reemplazamiento celular en los tejidos altamente regenerativos y por otro lado la pérdida celular por apoptosis (Li y Xie, 2005; Snyder y Loring, 2005). La función de las células madre somáticas está finamente regulada para asegurar el equilibrio adecuado entre el re-emplazamiento celular y la provisión de un [número suficiente de células maduras diferenciadas para el mantenimiento de la función de tejidos y órganos, sin dar lugar a la formación de tumores.] |
Se ha propuesto que esta conversión celular que implica de-diferenciación y re-diferenciación de las células pueda suceder gracias a la reprogramación nuclear tanto a nivel genético como epigenético.
Diferentes experimentos demostraron inicialmente que células procedentes de la médula ósea pueden incorporarse en el tejido dañado a través del torrente sanguíneo y dar lugar a células del músculo esquelético, neuronas y glía, hepatocitos, células endoteliales, células del miocardio, células epiteliales del intestino, piel y pulmón; mientras que por otro lado también se ha demostrado que células neuronales producen células de la sangre y células musculares esqueléticas (Blau y cols., 2001). Sin embargo, este concepto de transdiferenciación ha sido ampliamente discutido y rechazado en muchos estudios por considerarse que se trata de un fenómeno de fusión celular (Álvarez-Dolado y cols., 2003). Se ha demostrado la fusión de células transplantadas con las células del huésped receptor (Liu y Rao, 2003). Se trata de un fenómeno infrecuente y puede ocurrir entre células y tejidos donde la poliploidía es un fenómeno biológico normal, como en los osteoclastos, miotúbulos, hepatocitos y placenta. No obstante, la fusión celular puede ser mal interpretada como transdiferenciación (Goodell, 2003; Cossu, 2004). Finalmente la transdiferenciación como mecanismo de plasticidad debe de seguir siendo analizada a través de las herramientas y pruebas experimentales realizadas con rigor científico incluyendo un adecuado diseño experimental y la exclusión de la posibilidad de fusión celular en estos ensayos. Papel en la homeostasis, reparación y regeneración. Las células madre procedentes de órganos y tejidos adultos juegan un papel clave en la homeostasis celular ya que promueven por un lado el reemplazamiento celular en los tejidos altamente regenerativos y por otro lado la pérdida celular por apoptosis (Li y Xie, 2005; Snyder y Loring, 2005). La función [página 18] de las células madre somáticas está finamente regulada para asegurar el equilibrio adecuado entre el re-emplazamiento celular y la provisión de un número suficiente de células maduras diferenciadas para el mantenimiento de la función de tejidos y órganos, sin dar lugar a la formación de tumores. |
La fuente no se menciona. |
|
| [20.] Xsc/Fragment 016 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:19 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 16, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 16, 17, Zeilen: 16: 3pp.; 17: 1 ss. |
|---|---|
| Plasticidad de las células madre somáticas.
Se define la plasticidad celular como la capacidad de una célula madre somática de un tejido especifico para generar un tipo celular especializado diferente al de su origen embrionario. Por lo tanto, para evaluar la plasticidad en condiciones experimentales deben cumplirse criterios básicos que incluyen: la capacidad de auto-renovación, la diferenciación morfológica y funcional hacia tipos celulares de su origen embrionario y por lo menos a un tipo celular de diferente linaje. La mayoría de los estudios sobre plasticidad de las células madre se han realizado en ratones y en minoría en células humanas. Uno de los trabajos que demuestra la plasticidad de las células madre somáticas fue publicado en 2002 (Jiang y cols., 2002) donde a través de experimentos con poblaciones clonales de células madre mesenquimales derivadas de médula ósea de ratón y rata, se identificó una subpoblación denominada células progenitoras multipotentes adultas (Multipotent Adult Progenitor Cells, MAPCs), que no solo se diferenciaron a células mesenquimales, sino también a células con características morfológicas y marcadores celulares típicos de células neuronales, endoteliales y endodérmicas. También en humanos se han identificado MAPCs que poseen la capacidad de diferenciarse a células hepáticas (Reyes y Verfaillie, 2001). El problema de estos trabajos es que son difícilmente repetibles por otros autores. La transdiferenciación es la conversión de células de un tejido o linaje a células de otro linaje diferente, con consecuente pérdida de los marcadores de ese tejido específico y de su función celular, y por otro lado también adquisición de funciones y marcadores del nuevo tipo celular, sin que en este caso intervenga la división celular (Horwitz, 2002). Esto implica reprogramación de la maquinaria de transcripción nuclear de la célula y representa una forma de metaplasia o de alteración de los genes claves en el desarrollo (Reynolds y Rietze, 2005). La transdiferenciación puede ocurrir con o sin la intervención de división celular (Tosh y cols., 2002). Se ha propuesto que esta conversión celular que implica de-diferenciación y re-diferenciación de las células pueda [suceder gracias a la reprogramación nuclear tanto a nivel genético como epigenético.] |
Plasticidad de las células madre somáticas.
Se define la plasticidad celular como la capacidad de una célula madre somática de un tejido especifico para generar un tipo celular especializado diferente al de su origen embrionario. Por lo tanto, para evaluar la plasticidad en condiciones experimentales deben cumplirse criterios básicos que incluyen: la capacidad de auto-renovación, la diferenciación morfológica y funcional hacia tipos celulares de su origen embrionario y por lo menos a un tipo celular de diferente linaje. La mayoría de los estudios sobre plasticidad de las células madre se han realizado en ratones y en minoría en células humanas. Uno de los trabajos que demuestra la plasticidad de las células madre somáticas fue publicado en 2002 (Jiang y cols., 2002) donde a través de experimentos con poblaciones clonales de células madre mesenquimales derivadas de médula ósea de ratón y rata, se identificó una subpoblación denominada células progenitoras multipotentes adultas (Multipotent Adult Progenitor Cells, MAPCs), que no solo se diferenciaron a células mesenquimales, sino también a células con características morfológicas y marcadores celulares típicos de células neuronales, endoteliales y endodérmicas. También en humanos se han identificado MAPCs que poseen la capacidad de diferenciarse a células hepáticas (Reyes y Verfaillie, 2001). El problema de estos trabajos es que son difícilmente repetibles por otros autores. La transdiferenciación es la conversión de células de un tejido o linaje a células de otro linaje diferente, con consecuente pérdida de los marcadores de ese tejido específico y de su función celular, y por otro lado también adquisición de funciones y marcadores del nuevo tipo celular, sin que en este caso intervenga la división celular (Horwitz, 2002). Esto implica reprogramación de la maquinaria de transcripción nuclear de la célula y representa una forma de metaplasia o de alteración de los genes claves en el desarrollo (Reynolds y Rietze, 2005). La transdiferenciación puede ocurrir con o sin la intervención de [página 17] división celular (Tosh y cols., 2002). Se ha propuesto que esta conversión celular que implica de-diferenciación y re-diferenciación de las células pueda suceder gracias a la reprogramación nuclear tanto a nivel genético como epigenético. |
La fuente no se menciona. |
|
| [21.] Xsc/Fragment 015 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:17 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 15, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 15, 16, Zeilen: 15: 5 ss.; 16: 1 ss. |
|---|---|
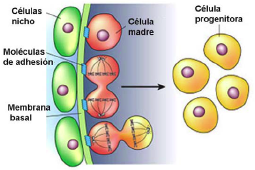
| [Las moléculas de adhesión junto con las células del] nicho anclan a las células madre somáticas a sus alrededor durante los periodos de inactividad de estas células y, dirigen la división asimétrica de las células madre somáticas seguida de la proliferación y diferenciación de estas en el momento y lugar que se precise. Entre las moléculas de adhesión descritas que juegan un papel esencial en el nicho de las células madre se encuentran las cadherinas que median en las interacciones adhesivas entre el nicho y las células madre (figura 3), y las integrinas, las cuales interactúan con la matriz extracelular (Wilson y Trumpp, 2006).
Figura 3. Representación del nicho de células madre somáticas. Las células nicho dirigen vía señalización celular el futuro de las células madre somáticas a través del inicio y/o bloqueo de la diferenciación celular y de la regulación de los ciclos celulares. Los nichos celulares mantienen a las células madre somáticas en un estado quiescente (en la fase de reposo del ciclo celular conocida como G0) a través de micro ambientes moleculares de señalización inhibitorios frente a la división y a la diferenciación celular, entre los cuales a menudo están implicados el factor de crecimiento transformante-β (TGFβ) y miembros de la familia de la proteína morfogenética del hueso BMP (Li y Xie, 2005). Uno de los papeles más importante del nicho celular es detectar la necesidad del re-emplazamiento celular, y transmitir las señales hacia las células residentes para que estas puedan alcanzar el destino celular final mediante la proliferación celular. |
Las moléculas de adhesión junto con las células del nicho anclan a las células madre somáticas a sus alrededor durante los periodos de inactividad de estas células y, dirigen la división asimétrica de las células madre somáticas seguida de la proliferación y diferenciación de estas en el momento y lugar que se precise. Entre las moléculas de adhesión descritas que juegan un papel esencial en el nicho de las células madre se encuentran las cadherinas que median en las interacciones adhesivas entre el nicho y las células madre (figura 3), y las integrinas, las cuales interactúan con la matriz extracelular (Wilson y Trumpp, 2006).
Figura 3. Representación del nicho de células madre somáticas. Las células nicho dirigen vía señalización celular el futuro de las células madre somáticas a través del inicio y/o bloqueo de la diferenciación celular y de la regulación de los ciclos celulares. Los nichos celulares mantienen a las células madre somáticas en un estado quiescente (en la fase de reposo del ciclo celular conocida como G0) a través de micro ambientes moleculares de señalización inhibitorios frente a la división y a la diferenciación celular, entre los cuales a menudo están implicados el factor de crecimiento transformante-β (TGFβ) y miembros de la familia de la proteína morfogenética del hueso BMP (Li y Xie, 2005). Uno de los papeles más importante del nicho celular es detectar la necesidad del re-emplazamiento celular, y transmitir las señales hacia las [página 16] células residentes para que estas puedan alcanzar el destino celular final mediante la proliferación celular. |
La fuente no se menciona. |
|
| [22.] Xsc/Fragment 014 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:14 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 14, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 14, 15, Zeilen: 14: 5ss.; 15: 1 ss. |
|---|---|
| [Otro caso es el de las células madre hematopoyéticas,] cuyas células madre somáticas y su progenie tienen capacidad de auto-renovación y diferenciación continua dependiendo de la fase del ciclo celular en la que se encuentren y del micro ambiente que les rodee (Quesenberry y cols., 2005).
Concepto de nicho. En 1978 Schofield fue el primero en proponer que las células madre eran reguladas en función del micro ambiente fisiológico en él que se encontraban, a este lugar tan excepcional lo llamó nicho (Schofield, 1978). La mayoría de los trabajos actuales sobre los nichos de células madre somáticas han sido obtenidos a través de estudios en modelos animales, como en el caso de los testículos de Caenorhabditas elegans y de los ovarios de Drosophila melanogaster, donde la localización de cada célula ha sido minuciosamente estudiada (Ohlstein y cols., 2004). Lejos está la localización tan precisa en el caso de los mamíferos ya que se trata de organismos mucho más complejos. Aún así existen características comunes entre las particularidades del nicho de células madre en Drosophila y en los mamíferos adultos, entre las que se incluye la localización exacta de las células madre en estrecha relación con una o más células diferenciadas que se encuentran circundando la región candidata; y que junto a la matriz extracelular y a varias moléculas secretadas dan lugar a un micro ambiente adecuado para regular las funciones claves de las células madre somáticas. Las características moleculares existentes en este nicho micro ambiental afectan a las propiedades intrínsecas de las células madre somáticas residentes que regulan la proliferación y el destino celular (Eckfeldt y cols., 2005). Los nichos tienen diferentes características en función de la composición celular, la estructura y la localización de las células madre en los diferentes tejidos adultos. En la actualidad, se ha identificado y caracterizado el nicho de las células madre epidérmicas en la región bulbar del folículo piloso (Fuchs y cols., 2004), también se ha descrito este nicho en el intestino delgado situándose en este caso en las células epiteliales de las criptas glandulares (Booth y Potten, 2000). |
Otro caso es el de las células madre hematopoyéticas, cuyas células madre somáticas y su progenie tienen capacidad de auto-renovación y diferenciación continua dependiendo de la fase del ciclo celular en la que se encuentren y del micro ambiente que les rodee (Quesenberry y cols., 2005).
Concepto de nicho. En 1978 Schofield fue el primero en proponer que las células madre eran reguladas en función del micro ambiente fisiológico en él que se encontraban, a este lugar tan excepcional lo llamó nicho (Schofield, 1978). La mayoría de los trabajos actuales sobre los nichos de células madre somáticas han sido obtenidos a través de estudios en modelos animales, como en el caso de los testículos de Caenorhabditas elegans y de los ovarios de Drosophila melanogaster, donde la localización de cada célula ha sido minuciosamente estudiada (Ohlstein y cols., 2004). Lejos está la localización tan precisa en el caso de los mamíferos ya que se trata de organismos mucho más complejos. Aún así existen características comunes entre las particularidades del nicho de células madre en Drosophila y en los mamíferos adultos, entre las que se incluye la localización exacta de las células madre en estrecha relación con una o más células diferenciadas que se encuentran circundando la región candidata; y que junto a la matriz extracelular y a varias moléculas secretadas dan lugar a un micro ambiente adecuado para regular las funciones claves de las células madre somáticas. Las características moleculares existentes en este nicho micro ambiental afectan a las propiedades intrínsecas de las células madre somáticas residentes que regulan la proliferación y el destino celular (Eckfeldt y cols., 2005). Los nichos tienen diferentes características en función de la composición celular, la estructura y la localización de las células madre en los diferentes [página 15] tejidos adultos. En la actualidad, se ha identificado y caracterizado el nicho de las células madre epidérmicas en la región bulbar del folículo piloso (Fuchs y cols., 2004), también se ha descrito este nicho en el intestino delgado situándose en este caso en las células epiteliales de las criptas glandulares (Booth y Potten, 2000). |
La fuente no se menciona. |
|
| [23.] Xsc/Fragment 013 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:11 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 13, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 13, 14, Zeilen: 13: 6ss.; 14: 1 ss. |
|---|---|
| Las células madre hematopoyéticas de médula ósea (encargadas de la formación de la sangre) son uno de los ejemplos más conocidos de este tipo celular somático y además son empleadas en aplicaciones clínicas desde hace tiempo.
Figura 2. Esquema de la jerarquía de la diferenciación de las células madre. Las células madre son capaces de auto-renovarse y de diferenciarse a células progenitoras comprometidas. Estas proliferan y dan lugar a células de amplificación transitoria, las cuales darán lugar finalmente a células diferenciadas y funcionales sin capacidad de proliferación. Los estudios más recientes sugieren que el dogma de la diferenciación jerárquica de las células madre y de sus progenitoras sea cada día más flexible de lo que se ha expuesto anteriormente. Como ocurre en el caso del tejido epidérmico; las células madre somáticas epidérmicas, las células TA de este tejido y las células diferenciadas de este tejido, los queratinocitos, tienen todos la capacidad de regenerar completamente la epidermis estratificada junto con la apropiada expresión de marcadores de diferenciación en el espacio y en el tiempo (Li y cols., 2004). |
Las células madre hematopoyéticas de médula ósea (encargadas de la formación de la sangre) son uno de los ejemplos más conocidos de este tipo celular somático y además son empleadas en aplicaciones clínicas desde hace tiempo.
Figura 2. Esquema de la jerarquía de la diferenciación de las células madre. Las células madre son capaces de auto-renovarse y de diferenciarse a células progenitoras comprometidas. Estas proliferan y dan lugar a células de amplificación transitoria, las cuales darán lugar finalmente a células diferenciadas y funcionales sin capacidad de proliferación. Los estudios más recientes sugieren que el dogma de la diferenciación jerárquica de las células madre y de sus progenitoras sea cada día más flexible de lo que se ha expuesto anteriormente. Como ocurre en el caso del tejido [página 14] epidérmico; las células madre somáticas epidérmicas, las células TA de este tejido y las células diferenciadas de este tejido, los queratinocitos, tienen todos la capacidad de regenerar completamente la epidermis estratificada junto con la apropiada expresión de marcadores de diferenciación en el espacio y en el tiempo (Li y cols., 2004). |
La fuente no se menciona. |
|
| [24.] Xsc/Fragment 012 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:09 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 12, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 12, 13, Zeilen: 12: 5 ss.; 13: 1 ss. |
|---|---|
| Definiciones y conceptos.
Las células madre somáticas son células indiferenciadas que se encuentran presentes en muchos órganos y tejidos adultos. Su singularidad, escasez y la falta tanto de características morfológicas distintivas como marcadores específicos hacen que su identificación y localización sean muy complejas en la mayoría de los tejidos estudiados. Gran parte de las células madre somáticas son definidas por sus propiedades funcionales, entre las cuales se incluye el alto potencial de proliferación, la importante capacidad reparadora y la capacidad para diferenciarse hacia las estirpes celulares de las que provienen e incluso hacia otras distintas (Weissman, 2002; Potten y Loeffler, 1990; Eckfeldt y cols., 2005). La propiedad de auto-renovación de estas células madre o la capacidad de producir células hijas idénticas a sí mismas es esencial para mantener la reserva de células madre en los tejidos adultos. La división celular asimétrica es el mecanismo llevado a cabo por estas células somáticas para producir por un lado una célula hija idéntica a sí mismas y, por otro lado una célula hija diferenciada (figura 2). Al mismo tiempo las células madre también sufren divisiones simétricas desde las llamadas progenitoras, produciendo dos células hijas o dos células progenitoras de amplificación transitoria (transit amplifying cells, TA) (Gargett, 2006). A continuación vendría la diferenciación, que se define como el cambio en el fenotipo celular debido a la expresión de diferentes genes asociados normalmente con la función de la célula a partir de la cuál se dividieron. Las células madre exhiben un amplio rango de potencial de diferenciación. Las células madre embrionarias son pluripotenciales y tienen capacidad de diferenciación a todos los tipos celulares provenientes de las tres hojas embrionarias (ectodermo, endodermo y mesodermo). La capacidad de diferenciación de estas células se ve disminuida a medida que aumenta el desarrollo embrionario. Finalmente, entre la descendencia se encontraran células madre multipotentes o células madre somáticas que se diferencian en un gran número de linajes celulares y producen los tipos celulares de los tejidos [en los que se encuentran.] |
Definiciones y conceptos.
Las células madre somáticas son células indiferenciadas que se encuentran presentes en muchos órganos y tejidos adultos. Su singularidad, escasez y la falta tanto de características morfológicas distintivas como marcadores específicos hacen que su identificación y localización sean muy complejas en la mayoría de los tejidos estudiados. Gran parte de las células madre somáticas son definidas por sus propiedades funcionales, entre las cuales se incluye el alto potencial de proliferación, la importante capacidad reparadora y la capacidad para diferenciarse hacia las estirpes celulares de las que provienen e incluso hacia otras distintas (Weissman, 2002; Potten y Loeffler, 1990; Eckfeldt y cols., 2005). La propiedad de auto-renovación de estas células madre o la capacidad de producir células hijas idénticas a sí mismas es esencial para mantener la reserva de células madre en los tejidos adultos. La división celular asimétrica es el mecanismo llevado a cabo por estas células somáticas para producir por un lado una célula hija idéntica a sí mismas y, por otro lado una célula hija diferenciada (figura 2). Al mismo tiempo las células madre también sufren divisiones simétricas desde las llamadas progenitoras, produciendo dos células hijas o dos células progenitoras de amplificación transitoria (transit amplifying cells, TA) (Gargett, 2006). A continuación vendría la diferenciación, que se define como el cambio en el fenotipo celular debido a la expresión de diferentes genes asociados normalmente con la función de la célula a partir de la cuál se dividieron. Las células madre exhiben un amplio rango de potencial de diferenciación. Las células madre embrionarias son pluripotenciales y tienen capacidad de diferenciación a todos los tipos celulares provenientes de las tres [página 13] hojas embrionarias (ectodermo, endodermo y mesodermo). La capacidad de diferenciación de estas células se ve disminuida a medida que aumenta el desarrollo embrionario. Finalmente, entre la descendencia se encontraran células madre multipotentes o células madre somáticas que se diferencian en un gran número de linajes celulares y producen los tipos celulares de los tejidos en los que se encuentran. |
La fuente no se menciona. |
|
| [25.] Xsc/Fragment 011 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:07 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 11, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 11, 12, Zeilen: 11. 4ss.; 12: 1 ss. |
|---|---|
| [Sin embargo, las células madre de teratocarcinomas embrionarios no conservan la misma capacidad pluripotente de las células] embrionarias tempranas y sufren cambios durante su transición in vivo al estado tumoral (Andrews, 2002).
1.2.4 Células madre somáticas. En la mayoría de los tejidos de individuos adultos, existen pequeñas poblaciones de células indiferenciadas que poseen la capacidad de diferenciarse a tipos celulares maduros, dividiéndose a su vez para mantener el balance necesario de células progenitoras indiferenciadas (Fuchs y Segre, 2000). Dichas poblaciones de células madre se mantienen a lo largo de la vida del individuo y reciben el nombre de células madre somáticas. La identificación y caracterización de estas células madre es uno de los mayores retos científicos que existen hoy en día debido al bajo número de células candidatas existentes en los tejidos residentes y a la falta de marcadores de superficie definitorios que permitan su aislamiento para su posterior estudio. Las células madre somáticas, desempeñan un papel esencial en el organismo, no sólo por su contribución en la formación de órganos y tejidos, sino sobre todo, por encargarse del mantenimiento y renovación de los mismos durante todo el proceso del desarrollo ontogénico (Firulli y Olson, 1997; Orkin, 1998; Edlund y Jessell, 1999). Estas células ya han sido descritas en multitud de tejidos. Aunque se pensaba que sólo generaban células características del tejido en el que residen o de otros con el mismo origen embrionario, algunos autores han descrito el fenómeno de transdiferenciación (Jiang y cols., 2002; Poulsom y cols., 2001; Mezey y cols., 2003). Dicho fenómeno consiste en que determinadas poblaciones de células madre somáticas son capaces de dar lugar a células de otro tipo de tejido distinto del que proceden, en función del micro ambiente que las rodea, es decir, poseen una plasticidad mayor de la esperada (Reyes y Verfaillie, 2001). |
Sin embargo, las células madre de teratocarcinomas embrionarios no conservan la misma capacidad pluripotente de las células embrionarias tempranas y sufren cambios durante su transición in vivo al estado tumoral (Andrews, 2002).
1.2.4 Células madre somáticas. En la mayoría de los tejidos de individuos adultos, existen pequeñas poblaciones de células indiferenciadas que poseen la capacidad de diferenciarse a tipos celulares maduros, dividiéndose a su vez para mantener el balance necesario de células progenitoras indiferenciadas (Fuchs y Segre, 2000). Dichas poblaciones de células madre se mantienen a lo largo de la vida del individuo y reciben el nombre de células madre somáticas. La identificación y caracterización de estas células madre es uno de los mayores retos científicos que existen hoy en día debido al bajo número de células candidatas existentes en los tejidos residentes y a la falta de marcadores de superficie definitorios que permitan su aislamiento para su posterior estudio. Las células madre somáticas, desempeñan un papel esencial en el organismo, no sólo por su contribución en la formación de órganos y tejidos, sino sobre todo, por encargarse del mantenimiento y renovación de los mismos durante todo el proceso del desarrollo ontogénico (Firulli y Olson, 1997; Orkin, 1998; Edlund y Jessell, 1999). Estas células ya han sido descritas en multitud de tejidos. Aunque se pensaba que sólo generaban células características del tejido en el que residen o de otros con el mismo origen embrionario, algunos autores han descrito el fenómeno de transdiferenciación (Jiang y cols., 2002; Poulsom y cols., 2001; Mezey y cols., 2003). Dicho fenómeno consiste en que determinadas [página 12] poblaciones de células madre somáticas son capaces de dar lugar a células de otro tipo de tejido distinto del que proceden, en función del micro ambiente que las rodea, es decir, poseen una plasticidad mayor de la esperada (Reyes y Verfaillie, 2001). |
La fuente no se menciona. |
|
| [26.] Xsc/Fragment 010 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:04 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 10, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 10, 11, Zeilen: 10: 2 ss.; 11: 1 ss. |
|---|---|
| [Los teratocarcinomas son tumores que aparecen en las gónadas de algunas cepas de ratones consanguíneos o tras depositar derivados celulares del] embrión bajo la cápsula suprarrenal de ratones inmunodeficientes (Anderson y cols., 1996). Estos tumores están constituidos por una amalgama de tejidos somáticos yuxtapuestos de manera desorganizada. Derivan de células germinales, son pluripotentes y por ello pueden dar lugar a los múltiples tipos celulares encontrados (Kleinsmith y Pierce, 1964; Stevens, 1984).
Las primeras líneas de células madre aisladas a partir de teratocarcinomas se obtuvieron en los años setenta (Kahan y Ephrussi., 1970; Jakob y cols., 1973; Gearhart y Mintz, 1974; Nicolas y cols., 1976). Las células madre de los teratocarcinomas conservan su capacidad de diferenciación, produciendo derivados de las tres hojas embrionarias: ectodermo, mesodermo y endodermo (Nicolas y cols., 1976). Sus características se recogen en la Tabla I. Tabla I. Propiedades de las células madre de teratocarcinomas embrionarios. Además estas células madre conservan su capacidad de contribución al desarrollo embrionario y tras microinyectarlas en la masa celular interna de blastocistos de ratón, dan lugar a animales quiméricos viables y fértiles (Mintz y Illmensee, 1975). Sin embargo, las células madre de teratocarcinomas embrionarios no conservan la misma capacidad pluripotente de las células [embrionarias tempranas y sufren cambios durante su transición in vivo al estado tumoral (Andrews, 2002).] |
Los teratocarcinomas son tumores que aparecen en las gónadas de algunas cepas de ratones consanguíneos o tras depositar derivados celulares del embrión bajo la cápsula suprarrenal de ratones inmunodeficientes (Anderson y cols., 1996). Estos tumores están constituidos por una amalgama de tejidos somáticos yuxtapuestos de manera desorganizada. Derivan de células germinales, son pluripotentes y por ello pueden dar lugar a los múltiples tipos celulares encontrados (Kleinsmith y Pierce, 1964; Stevens, 1984).
Las primeras líneas de células madre aisladas a partir de teratocarcinomas se obtuvieron en los años setenta (Kahan y Ephrussi., 1970; Jakob y cols., 1973; Gearhart y Mintz, 1974; Nicolas y cols., 1976). Las células madre de los teratocarcinomas conservan su capacidad de diferenciación, produciendo derivados de las tres hojas embrionarias: ectodermo, mesodermo y endodermo (Nicolas y cols., 1976). Sus características se recogen en la Tabla I. Tabla I. Propiedades de las células madre de teratocarcinomas embrionarios. [página 11] Además estas células madre conservan su capacidad de contribución al desarrollo embrionario y tras microinyectarlas en la masa celular interna de blastocistos de ratón, dan lugar a animales quiméricos viables y fértiles (Mintz y Illmensee, 1975). Sin embargo, las células madre de teratocarcinomas embrionarios no conservan la misma capacidad pluripotente de las células embrionarias tempranas y sufren cambios durante su transición in vivo al estado tumoral (Andrews, 2002). |
La fuente no se menciona. |
|
| [27.] Xsc/Fragment 009 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 23:01 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 9, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 9, 10, Zeilen: 9: 1 ss.; 10: 1ss. |
|---|---|
| 1.2.2 Células madre germinales.
Se obtienen de la cresta gonadal de embriones humanos de 5-9 semanas de gestación y son las precursoras de los gametos. Las células madre germinales o “primordial germ cells” (PGC) tienen propiedades bioquímicas, morfológicas, inmunológicas y de desarrollo comunes a las células madre embrionarias ya que son pluripotentes y contribuyen a la formación de la línea germinal cuando se inyectan en blastocistos dando lugar a animales quiméricos (Matsui y cols., 1992; Stewart y cols., 1994). Asimismo, pueden diferenciarse a cuerpos embrioides y formar teratomas in vivo. No obstante, existen diferencias a nivel del patrón de metilación de estos tipos celulares ya que la secuencia de ADN se mantiene inalterada pero su capacidad de expresión se ve modificada. Dichas diferencias podrían reflejar los cambios en el programa de desarrollo de las PGC versus las ESC. A pesar de ello, la existencia de este patrón de metilación génica no parece afectar a la capacidad de estas células para contribuir al desarrollo de la línea germinal en quimeras (Sato y cols., 2003). Existe una gran variabilidad en la expresión de los genes sujetos a imprinting o mecanismo de regulación génica donde los genes pueden modificar su funcionamiento sin necesidad de un cambio en la secuencia del ADN en las líneas de células germinales primordiales, ya que en algunos de los descendientes de ratones quiméricos resultantes de la inyección de estas células, se puede ver que los genes de las PGC se transmiten de forma normal, mientras que en otros casos, los animales descendientes presentan anomalías a nivel de crecimiento y de la estructura ósea. Aunque la mayor parte de los estudios se han realizado en ratón (Matsui y cols., 1992), cada vez existe un mayor interés en la obtención de PGC humanas (Shamblott y cols., 1998; 2001). 1.2.3 Células madre de teratocarcinomas. Los teratocarcinomas son tumores que aparecen en las gónadas de algunas cepas de ratones consanguíneos o tras depositar derivados celulares del [embrión bajo la cápsula suprarrenal de ratones inmunodeficientes (Anderson y cols., 1996).] |
1.2.2 Células madre germinales.
Se obtienen de la cresta gonadal de embriones humanos de 5-9 semanas de gestación y son las precursoras de los gametos. Las células madre germinales o “primordial germ cells” (PGC) tienen propiedades bioquímicas, morfológicas, inmunológicas y de desarrollo comunes a las células madre embrionarias ya que son pluripotentes y contribuyen a la formación de la línea germinal cuando se inyectan en blastocistos dando lugar a animales quiméricos (Matsui y cols., 1992; Stewart y cols., 1994). Asimismo, pueden diferenciarse a cuerpos embrioides y formar teratomas in vivo. No obstante, existen diferencias a nivel del patrón de metilación de estos tipos celulares ya que la secuencia de ADN se mantiene inalterada pero su capacidad de expresión se ve modificada. Dichas diferencias podrían reflejar los cambios en el programa de desarrollo de las PGC versus las ESC. A pesar de ello, la existencia de este patrón de metilación génica no parece afectar a la capacidad de estas células para contribuir al desarrollo de la línea germinal en quimeras (Sato y cols., 2003). Existe una gran variabilidad en la expresión de los genes sujetos a imprinting o mecanismo de regulación génica donde los genes pueden modificar su funcionamiento sin necesidad de un cambio en la secuencia del ADN en las líneas de células germinales primordiales, ya que en algunos de los descendientes de ratones quiméricos resultantes de la inyección de estas células, se puede ver que los genes de las PGC se transmiten de forma normal, mientras que en otros casos, los animales descendientes presentan anomalías a nivel de crecimiento y de la estructura ósea. Aunque la mayor parte de los estudios se han realizado en ratón (Matsui y cols., 1992), cada vez existe un mayor interés en la obtención de PGC humanas (Shamblott y cols., 1998; 2001). [página 10] 1.2.3 Células madre de teratocarcinomas. Los teratocarcinomas son tumores que aparecen en las gónadas de algunas cepas de ratones consanguíneos o tras depositar derivados celulares del embrión bajo la cápsula suprarrenal de ratones inmunodeficientes (Anderson y cols., 1996). |
La fuente no se menciona. |
|
| [28.] Xsc/Fragment 008 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 22:59 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 8, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 8, Zeilen: 1 ss. |
|---|---|
| 1.2.1 Células madre embrionarias.
Las células madre embrionarias humanas, aisladas por primera vez en 1998 (Thomson y Marshall, 1998) proceden de la masa celular interna del embrión en estado de blastocisto, y poseen una elevada capacidad de auto-renovación e indiferenciación. Sin embargo, tienen problemas legales y éticos derivados de su origen. Debido a su procedencia, estas células se denominaron células madre embrionarias ó ESC, del inglés “Embryonic stem cells” . Según Marshall y cols. (2001) y Smith (2001) las características que definen las ESC son las siguientes: • Proceder de la masa celular interna de embriones en estado de blastocisto o mórula. • Tener capacidad de división asimétrica ilimitada, y mantenerse indiferenciadas en las condiciones de cultivo in vitro adecuadas. • Presentar cariotipo normal y que este permanezca estable. • Ser capaces de diferenciarse a derivados de las tres hojas embrionarias: ectodermo, mesodermo, endodermo y también células germinales (gametos). Por lo tanto tener capacidad pluripotente, lo que las convierte en un tipo celular único. • Cuando se transplantan durante el desarrollo embrionario murino, poseen la capacidad de integrarse en todos los tejidos fetales dando lugar a quimeras. • Tener la capacidad para colonizar la línea germinal dando lugar a ovocitos y espermatozoides. • Presentar expresión de marcadores de indiferenciación, entre ellos el factor de trascripción Oct-4, que regula gran número de genes y mantiene las células embrionarias en estado de proliferación e indiferenciación. • Poder inducir su proliferación o diferenciación bajo condiciones in vitro. |
1.2.1 Células madre embrionarias.
Las células madre embrionarias humanas, aisladas por primera vez en 1998 (Thomson y Marshall, 1998) proceden de la masa celular interna del embrión en estado de blastocisto, y poseen una elevada capacidad de auto-renovación e indiferenciación. Sin embargo, tienen problemas legales y éticos derivados de su origen. Debido a su procedencia, estas células se denominaron células madre embrionarias ó ESC, del inglés “Embryonic stem cells” . Según Marshall y cols. (2001) y Smith (2001) las características que definen las ESC son las siguientes: • Proceder de la masa celular interna de embriones en estado de blastocisto o mórula. • Tener capacidad de división asimétrica ilimitada, y mantenerse indiferenciadas en las condiciones de cultivo in vitro adecuadas. • Presentar cariotipo normal y que este permanezca estable. • Ser capaces de diferenciarse a derivados de las tres hojas embrionarias: ectodermo, mesodermo, endodermo y también células germinales (gametos). Por lo tanto tener capacidad pluripotente, lo que las convierte en un tipo celular único. • Cuando se transplantan durante el desarrollo embrionario murino, poseen la capacidad de integrarse en todos los tejidos fetales dando lugar a quimeras. • Tener la capacidad para colonizar la línea germinal dando lugar a ovocitos y espermatozoides. • Presentar expresión de marcadores de indiferenciación, entre ellos el factor de trascripción Oct-4, que regula gran número de genes y mantiene las células embrionarias en estado de proliferación e indiferenciación. • Poder inducir su proliferación o diferenciación bajo condiciones in vitro. |
La fuente no se menciona. |
|
| [29.] Xsc/Fragment 007 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 12. November 2014, 22:52 (Hindemith) | Cervello 2009, Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Xsc |
|
|
| Untersuchte Arbeit: Seite: 7, Zeilen: 1 ss. (página entera) |
Quelle: Cervello 2009 Seite(n): 7, Zeilen: 1 ss. |
|---|---|
| I.- INTRODUCCIÓN
1.- CÉLULAS MADRE En los últimos años la Medicina y la Biología han experimentado grandes avances. Uno de los más recientes se ha denominado Medicina Regenerativa (Robey, 2000) y está basado principalmente en el conocimiento y uso terapéutico de las células madre con la finalidad de regenerar tejidos u órganos dañados y, de este modo, poder tratar enfermedades crónico-degenerativas. 1.1 Definición de célula madre. Según Alberts y cols. 1994 “una célula madre es toda aquella que no está totalmente diferenciada, tiene capacidad de división ilimitada y cuando se divide, cada célula puede permanecer como célula madre o puede iniciar una vía que conduce de forma irreversible a su diferenciación terminal”. 1.2 Tipos de células madre y clasificación. A lo largo del desarrollo ontogénico, podemos identificar y aislar distintos tipos de células madre. Atendiendo a su origen, las células madre pueden dividirse en cuatro grupos, tal y como se muestra en la figura 1: Figura 1. Desarrollo ontogénico y tipos de células madre, ESC=células madre embrionarias, PGC=células madre primordiales, ECC=células madre de teratocarcinomas, SSC=células madre somáticas. |
I.- INTRODUCCIÓN
1.- CÉLULAS MADRE En los últimos años la Medicina y la Biología han experimentado grandes avances. Uno de los más recientes se ha denominado Medicina Regenerativa (Robey, 2000) y está basado principalmente en el conocimiento y uso terapéutico de las células madre con la finalidad de regenerar tejidos u órganos dañados y, de este modo, poder tratar enfermedades crónico-degenerativas. 1.1 Definición de célula madre. Según Alberts y cols. 1994 “una célula madre es toda aquella que no está totalmente diferenciada, tiene capacidad de división ilimitada y cuando se divide, cada célula puede permanecer como célula madre o puede iniciar una vía que conduce de forma irreversible a su diferenciación terminal”. 1.2 Tipos de células madre y clasificación. A lo largo del desarrollo ontogénico, podemos identificar y aislar distintos tipos de células madre. Atendiendo a su origen, las células madre pueden dividirse en cuatro grupos, tal y como se muestra en la figura 1: Figura 1. Desarrollo ontogénico y tipos de células madre, ESC=células madre embrionarias, PGC=células madre primordiales, ECC=células madre de teratocarcinomas, SSC=células madre somáticas. |
La fuente no se menciona. |
|
| [30.] Xsc/Fragment 052 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 11. November 2014, 00:15 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Wikipedia ELISA 2012, Xsc |
|
|
| Untersuchte Arbeit: Seite: 52, Zeilen: 1 ss. (página entera) |
Quelle: Wikipedia ELISA 2012 Seite(n): 1 (fuente online), Zeilen: - |
|---|---|
| 1. ELISA directo (ensayo ELISA simple de dos capas). Las placas ELISA se preparan recubriendo los pocillos con las soluciones en las que se encuentra el antígeno. Se incuban con anticuerpos marcados que indican la presencia de antígeno en la solución analizada. Es necesario tener controles positivos y negativos.
2. ELISA indirecto. El sistema de detección emplea dos anticuerpos: uno primario contra el antígeno y uno secundario marcado contra el primario. La detección tiene mayor sensibilidad por presentar una amplificación de señal debida a la unión de dos o más anticuerpos secundarios por cada primario. Es el ensayo más popular y el método más polivalente y barato, aunque se pierda algo de precisión por tener un eslabón más con respecto al método directo. 3. ELISA sándwich (Ensayo de captura de antígeno y detección mediante inmunocomplejos). Se trata de un ensayo muy empleado en el que se recubre el pocillo con un primer anticuerpo anti-antígeno. Después de lavar el exceso de anticuerpo se aplica la muestra problema en la que se encuentra el antígeno, que será retenido en el pocillo al ser reconocido por el primer anticuerpo. Después de un segundo lavado que elimina el material no retenido se aplica una solución con un segundo anticuerpo anti-antígeno marcado. Así pues cada molécula de antígeno estará unida a un anticuerpo en la base que lo retiene y un segundo anticuerpo, al menos, que lo marca. Este ensayo tiene una gran especificidad y sensibilidad debido a la amplificación de señal que permite el segundo anticuerpo. |
ELISA directo (ensayo ELISA simple de dos capas). Las placas ELISA se preparan recubriendo los pocillos con las soluciones en las que se sospecha se encuentra el antígeno. Se incuban con anticuerpos marcados. Indican la presencia de antígeno en la solución analizada. Es necesario incluir controles negativos que serán muestras del mismo tipo de las analizadas (sangre, orina,...) pero en las que se tenga la certeza de la ausencia del antígeno buscado. Asimismo se incluyen controles positivos (soluciones donde se encuentra el antígeno buscado).
ELISA indirecto. Las placas ELISA se preparan de la misma forma a la anterior. Los controles positivos y negativos son los mismos. El sistema de detección emplea dos anticuerpos: uno primario contra el antígeno y uno secundario marcado contra el primario. La detección tiene mayor sensibilidad por presentar una amplificación de señal debida a la unión de dos o más anticuerpos secundarios por cada primario. Es el ensayo más popular, como lo es la inmunofluorescencia indirecta, pues un mismo secundario marcado y un mismo sistema enzimático permite cuantificar una gran variedad de antígenos, por eso es un método más polivalente y barato, aunque se pierda algo de precisión por tener un eslabón más con respecto al método directo. [...] ELISA sándwich (Ensayo de captura de antígeno y detección mediante inmunocomplejos). Se trata de un ensayo muy empleado en el que se recubre el pocillo con un primer anticuerpo anti-antígeno. Después de lavar el exceso de anticuerpo se aplica la muestra problema en la que se encuentra el antígeno, que será retenido en el pocillo al ser reconocido por el primer anticuerpo. Después de un segundo lavado que elimina el material no retenido se aplica una solución con un segundo anticuerpo anti-antígeno marcado. Así pues cada molécula de antígeno estará unida a un anticuerpo en la base que lo retiene y un segundo anticuerpo, al menos, que lo marca. Este ensayo tiene una gran especificidad y sensibilidad debido a la amplificación de señal que permite el segundo anticuerpo. |
Falta una referencia al origen del texto. |
|
| [31.] Xsc/Fragment 051 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 11. November 2014, 00:10 (Hindemith) | Fragment, Gesichtet, KomplettPlagiat, SMWFragment, Schutzlevel sysop, Wikipedia ELISA 2012, Xsc |
|
|
| Untersuchte Arbeit: Seite: 51, Zeilen: 1 ss. (página entera) |
Quelle: Wikipedia ELISA 2012 Seite(n): 1 (fuente online), Zeilen: - |
|---|---|
| 2. Unión del antígeno (o del anticuerpo) a los pocillos. La unión de anticuerpos o antígenos se realiza con facilidad a la superficie de plásticos tratados que tienen gran afinidad por proteínas. Así, el procedimiento de recubrimiento de los pocillos debe realizarse cuidadosamente. Si se usa poco antígeno, se pueden obtener falsos positivos. Por el contrario, si se usa demasiado antígeno, el exceso dará lugar a una reacción falsa negativa.
3. Formación de una o más capas de inmunocomplejos. En el caso del antígeno unido a la placa se puede detectar mediante un anticuerpo anti-antígeno marcado (ELISA directo) o empleando un anticuerpo primario anti-antígeno y un secundario anti primario marcado (ELISA indirecto). Este segundo método permite la amplificación de la señal al poderse unir uno o más anticuerpos secundarios a cada anticuerpo primario. 4. Revelado de la reacción enzimática. Después de un lavado para eliminar todos las moléculas marcadas no fijadas en forma de inmunocomplejos se añade el sustrato enzimático en solución. Se deja reaccionar y se lee la densidad óptica (D.O.) mediante espectrofotometría. Tipos de ELISA: Se han desarrollado múltiples variantes de ensayos ELISA que permiten desde la cuantificación de un antígeno en solución, la detección de un anticuerpo en una solución (por ejemplo en el clonaje de anticuerpos monoclonales) o la determinación de la subclase (idiotipo) de un anticuerpo. A continuación se describen los más comunes (Figura 9): |
2. Unión del antígeno (o del anticuerpo) a los pocillos. La unión de anticuerpos o antígenos se realiza con facilidad a la superficie de plásticos tratados que tienen gran afinidad por proteínas. Así, el procedimiento de recubrimiento de los pocillos debe realizarse cuidadosamente. Si se usa poco antígeno, se pueden obtener falsos positivos. Por el contrario, si se usa demasiado antígeno, el exceso dará lugar a una reacción falsa negativa.
3. Formación de una o más capas de inmunocomplejos. En el caso del antígeno unido a la placa se puede detectar mediante un anticuerpo anti-antígeno marcado (ELISA directo) o empleando un anticuerpo primario anti-antígeno y un secundario anti primario marcado (ELISA indirecto). Este segundo método permite la amplificación de la señal al poderse unir uno o más anticuerpos secundarios a cada anticuerpo primario. [...] 4. Revelado de la reacción enzimática. Después de un lavado para eliminar todos las moléculas marcadas no fijadas en forma de inmunocomplejos se añade el sustrato enzimático en solución. Se deja reaccionar y se lee la densidad óptica (D.O.) mediante espectrofotometría. Tipos de ensayos ELISA Se han desarrollado múltiples variantes de ensayos ELISA que permiten desde la cuantificación de un antígeno en solución, la detección de un anticuerpo en una solución (por ejemplo en el clonaje de anticuerpos monoclonales) o la determinación de la subclase (idiotipo) de un anticuerpo. A continuación se describen los más comunes. |
Falta una referencia al origen del texto. |
|
| [32.] Xsc/Fragment 050 01 - Diskussion Bearbeitet: 17. November 2014, 21:43 Hindemith Erstellt: 11. November 2014, 00:06 (Hindemith) | Fragment, Gesichtet, SMWFragment, Schutzlevel sysop, Verschleierung, Wikipedia ELISA 2012, Xsc |
|
|
| Untersuchte Arbeit: Seite: 50, Zeilen: 1 ss. (página entera) |
Quelle: Wikipedia ELISA 2012 Seite(n): 1 (fuente online), Zeilen: - |
|---|---|
| Método ELISA
ELISA (Enzyme-Linked ImmunoSorbent Assay, Ensayo por inmunoabsorción ligado a enzimas) es una técnica de inmunoensayo en la cual un antígeno inmovilizado se detecta mediante un anticuerpo enlazado a una enzima capaz de generar un producto detectable como cambio de color; ese cambio de color permite medir indirectamente mediante espectrofotometría el antígeno en la muestra. En los últimos tiempos se han desarrollado diferentes métodos de amplificación de la señal (luminiscentes, cascadas enzimáticas...) que han permitido elevar la sensibilidad de algunos ELISA en comparación a la obtenida en el RIA (radioinmunoensayo) hormonal.El ELISA tiene muchas de las propiedades de un inmunoensayo ideal: es versátil, robusto, simple en su realización, mediante el uso de la fase sólida, una separación fácil entre la fracción retenida y la fracción libre. Los lectores ELISA son espectrofotómetros capaces de realizar lecturas seriadas de cada uno de los pocillos de la placa ELISA y que disponen de sistemas de filtros que sólo permiten la lectura de una o pocas longitudes de onda. Son la que se corresponden con las necesarias para determinar la densidad óptica de los cromógenos más comúnmente utilizados. Un ensayo ELISA consta de los siguientes 4 pasos: 1. Conjugacion del anticuerpo o del antígeno con un enzima (peroxidasa, fosfatasa alcalina...). Dicha unión anticuerpo-enzima o antígeno-enzima ha de producirse durante un determinado periodo de tiempo en aras de producir una solución coloreada y que pueda ser valorada visualmente o cuantificada por medio de un espectrofotómetro (normalmente a una longitud de onda de 414 nm). Si no transcurre el tiempo adecuado para que se de la reacción, no se evidenciará ningún color, interpretándose este resultado como un falso negativo, disminuyendo la sensibilidad de la técnica. |
ELISA
[...] ELISA (acrónimo del inglés Enzyme-Linked ImmunoSorbent Assay, Ensayo por inmunoabsorción ligado a enzimas) es una técnica de inmunoensayo en la cual un antígeno inmovilizado se detecta mediante un anticuerpo enlazado a una enzima capaz de generar un producto detectable como cambio de color o algún otro tipo; en ocasiones, con el fin de reducir los costos del ensayo, nos encontramos con que existe un anticuerpo primario que reconoce al antígeno y que a su vez es reconocido por un anticuerpo secundario que lleva enlazado la enzima anteriormente mencionada. La aparición de colorantes permite medir indirectamente mediante espectrofotometría el antígeno en la muestra. [...] Este principio tiene muchas de las propiedades de un inmunoensayo ideal: es versátil, robusto, simple en su realización, mediante el uso de la fase sólida, una separación fácil entre la fracción retenida y la fracción libre. Además se han propuesto y desarrollado diferentes métodos de amplificación de la señal (luminiscentes, cascadas enzimáticas...) que han permitido elevar la sensibilidad de algunos ELISA a la obtenida en el RIA (radioinmunoensayo) hormonal. [...] Los lectores ELISA son espectrofotómetros capaces de realizar lecturas seriadas de cada uno de los pocillos de la placa ELISA. A diferencia de un espectrofotómetro convencional, con capacidad de leer todas las longitudes de onda del ultravioleta y el visible de manera continua, los lectores de ELISA disponen de sistemas de filtros que sólo permiten la lectura de una o pocas longitudes de onda. Son la que se corresponden con las necesarias para determinar la densidad óptica de los cromógenos más comúnmente utilizados. [...] Las 4 fases de un ensayo ELISA son las siguientes: 1. Conjugacion del anticuerpo o del antígeno con un enzima (peroxidasa, fosfatasa alcalina...). El anticuerpo conjugado a la enzima se emplea en los ensayos directos e indirectos, sandwich, etc. El antígeno marcado se emplea en ensayos de competición de antígeno. Dicha unión anticuerpo-enzima o antígeno-enzima ha de producirse durante un determinado periodo de tiempo en aras de producir una solución coloreada y que pueda ser valorada visualmente o cuantificada por medio de un espectrofotómetro (normalmente a una longitud de onda de 414 nm). Si no transcurre el tiempo adecuado para que se de la reacción, no se evidenciará ningún color, interpretándose este resultado como un falso negativo, disminuyendo la sensibilidad de la técnica. |
Falta una referencia al origen del texto. |
|